Термодинамические константы равновесия.
В случае реальных систем равновесные концентрации в выражении (4.5) заменяют на равновесные активности (аi) и получают термодинамическую константу химического равновесия:
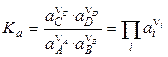 , (4.6)
, (4.6)
где ni – стехиометрические коэффициенты уравнения реакции. Величины 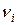 положительны для продуктов реакции и отрицательны для исходных веществ.
положительны для продуктов реакции и отрицательны для исходных веществ.
Константы химического равновесия, выраженные через равновесные парциальные давления рi или равновесные фугитивности fi участников реакции, имеют вид:
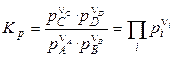 , (4.7)
, (4.7)
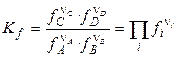 . (4.8)
. (4.8)
Приведенные выше равенства для констант равновесия выражают закон, который был сформулирован К. Гульдбергом и П. Вааге – закон действующих масс.
Отношение произведения равновесных парциальных давлений (концентраций) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к произведению равновесных парциальных давлений (концентраций) исходных веществ при данной температуре есть величина постоянная, называемая константой химического равновесия. Одним из важных выводов из закона действия масс заключается в установлении взаимосвязанности парциальных давлений (или концентраций) всех веществ, участвующих в реакции. В условиях равновесия парциальные давления (или концентрации) всех веществ, участвующих в реакции, связаны между собой. Нельзя изменить парциальное давление (или концентрации) ни одного из них, чтобы это не повлекло за собой такого изменения парциальных давлений (или концентраций) всех остальных веществ, участвующих в реакции, которое не привело бы к прежнему численному значению константы равновесия при данных условиях.
Найдем связь между КР и КС для реакций между идеальными газами. Выразим равновесные парциальные давления с помощью уравнения Менделеева–Клапейрона:
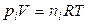
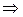
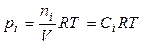 . (4.9)
. (4.9)
Тогда, на основании уравнений (4.5) и (4.7), имеем
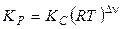 , (4.10)
, (4.10)
где Dn – изменение числа молей газообразных веществ в ходе реакции.
Дата добавления: 2016-06-18; просмотров: 3310;











