ТЕРМОДИНАМИКА ХИМИЧЕСКОГО РАВНОВЕСИЯ. КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС.
Химическим равновесиемназывается такое состояние обратимого процесса
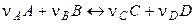 ,
,
при котором скорость прямой реакции ( 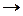 ) равна скорости обратной (
) равна скорости обратной (  ) реакции, и вследствие этого составсистемы со временем не изменяется. Равновесие устанавливается не потому, что процесс прекратился, а в результате протекания процесса в двух направлениях с одинаковой скоростью, т. е. равновесие имеет динамический характер. Кроме того, устойчивые равновесия характеризуются: неизменностью равновесного состояния системы при сохранении внешних условий; возможностью подхода к состоянию равновесия с двух противоположных сторон; подвижностью равновесия.
) реакции, и вследствие этого составсистемы со временем не изменяется. Равновесие устанавливается не потому, что процесс прекратился, а в результате протекания процесса в двух направлениях с одинаковой скоростью, т. е. равновесие имеет динамический характер. Кроме того, устойчивые равновесия характеризуются: неизменностью равновесного состояния системы при сохранении внешних условий; возможностью подхода к состоянию равновесия с двух противоположных сторон; подвижностью равновесия.
По основному постулату кинетики скорости прямого и обратного процессов выражаются следующим образом:
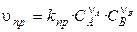 , (3.1)
, (3.1)
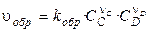 , (3.2)
, (3.2)
т.е. скорость химической реакции прямо пропорциональна концентрации реагирующих веществ, возведённых в степени их стехиометрических коэффициентов. kпр и kобр — константы скорости прямой и обратной реакций.
В равновесии:
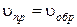 , (4.3)
, (4.3)
 . (4.4)
. (4.4)
Константы скорости прямой и обратной реакций не зависят от концентраций и при постоянной температуре являются постоянными величинами. Поэтому их отношение есть некоторая постоянная величина КС — константа химического равновесия:
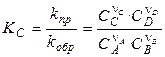 , (4.5)
, (4.5)
Константу КС, выраженную через концентрации участников реакции, называют классической константой равновесия.
Дата добавления: 2016-06-18; просмотров: 2127;











