ИЗОТЕРМА ХИМИЧЕСКОЙ РЕАКЦИИ.
Уравнение изотермы (или просто изотерма) химической реакции позволяет связать возможное направление химической реакции с исходным составом реагирующих веществ. При исследовании химических процессов чаще пользуются величиной DG, которая является индикатором реакционной способности веществ в процессах при Т, р = const.
Изменение энергии Гиббса в ходе протекания химической реакции между газообразными веществами равно
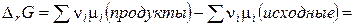
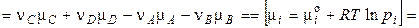
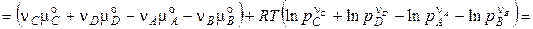
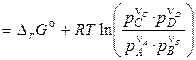 . (4.12)
. (4.12)
При наступлении равновесия в системе 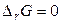 , тогда
, тогда
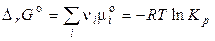 , (4.13)
, (4.13)
где 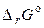 — стандартное изменение энергии Гиббса химической реакции (когда все вещества находятся в стандартных условиях).
— стандартное изменение энергии Гиббса химической реакции (когда все вещества находятся в стандартных условиях).
Значит,
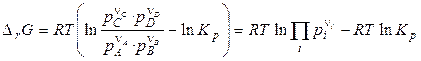 , (4.14)
, (4.14)
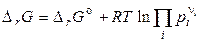 , (4.15)
, (4.15)
где pi — начальные (заданные) парциальные давления участников реакции.
Последние уравнения называют уравнениями изотермы химической реакции или уравнениями Вант–Гоффа. Они выражают зависимость DrG от состава системы, т. е. зависимость между термодинамическим потенциалом реакции DrG, константой химического равновесия (Кp) и условиями проведения реакции.
По уравнению изотермы химической реакции можно рассчитать изменение энергии Гиббса при соответствующих условиях, т.е. определить возможность, направление и предел протекания самопроизвольного процесса. Чтобы самопроизвольно осуществлялась прямая реакция, изменение энергии Гиббса (DrG) должно быть отрицательным, а это возможно при условии:
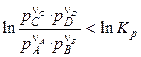 . (4.16)
. (4.16)
Если
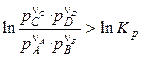 , (4.17)
, (4.17)
то самопроизвольно пойдет обратная реакция.
При установлении равновесия:
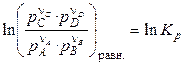 , (4.18)
, (4.18)
где pi — равновесные парциальные давления участников реакции.
Аналогичным способом получают выражение для изменения энергии Гельмгольца для процессов, протекающих при T, V = const:
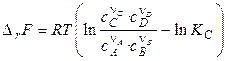 . (4.19)
. (4.19)
Дата добавления: 2016-06-18; просмотров: 3167;











