Осмос и осмотическое давление. Закон Вант-Гоффа.
Если трубку, заполненную раствором (например, сахара), отделить от воды полупроницаемой мембраной (которая пропускает только молекулы воды, но не сахара), то через мембрану происходит диффузия молекул воды в раствор и уровень жидкости в трубке поднимается. Это приводит к увеличению давления в нижней части раствора, что затрудняет дальнейшую диффузию воды. При некоторой высоте ( 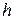 ) столба раствора в трубке скорости диффузии воды из наружнего сосуда во внутрений и обратно сравняются и подъём жидкости в трубке прекратится, т. е. система придёт в равновесие. Процесс односторонней диффузии растворителя через полупроницаемую перегородку от раствора с меньшей концентрацией растворенного вещества к раствору с большей концентрацией называют осмосом. Давление, которое нужно приложить в процессе осмоса к раствору, чтобы привести его уровень к уровню чистого растворителя, называют осмотическим давлением.
) столба раствора в трубке скорости диффузии воды из наружнего сосуда во внутрений и обратно сравняются и подъём жидкости в трубке прекратится, т. е. система придёт в равновесие. Процесс односторонней диффузии растворителя через полупроницаемую перегородку от раствора с меньшей концентрацией растворенного вещества к раствору с большей концентрацией называют осмосом. Давление, которое нужно приложить в процессе осмоса к раствору, чтобы привести его уровень к уровню чистого растворителя, называют осмотическим давлением.
Вант-Гофф, анализируя результаты изучения осмотического давления разных растворов, пришел к выводу: в разбавленных растворах (С ≤ 0,01моль/л) растворитель и раствореное вещество ведут себя подобно газам. Поэтому к разбавленным растворам применимо уравнение состояния идеальных газов в следующей форме:
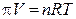 , (28)
, (28)
где π – осмотическое давление, n – число молей растворенного вещества. Решив это уравнение относительно p и произведя замену n/V = C, получают выражение, называемое законом Вант-Гоффа:
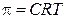 , (29)
, (29)
где С – концентрация растворенного вещества, моль/л.
Закон Рауля.
При анализе результатов измерений давления насыщенного пара растворов нелетучих веществ Ф.М. Рауль обнаружил важную закономерность:
парциальное давление насыщенного пара 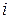 -го компонента над раствором (pi) равно произведению давления насыщенного пара над чистым компонентом (p0i) на мольную долю (xi) этого компонента в растворе:
-го компонента над раствором (pi) равно произведению давления насыщенного пара над чистым компонентом (p0i) на мольную долю (xi) этого компонента в растворе:
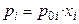 . (30)
. (30)
Уравнение (30) носит название закона Рауля.
Закон Генри.
Предельно разбавленными называются такие растворы, в которых молярная доля растворенного вещества x2 < 0,005 и, следовательно, молярная доля растворителя x1 близка к единице. Поведение растворенного вещества в предельно разбавленном растворе не подчиняется законам идеальных растворов. Давление насыщенного пара растворенного вещества линейно зависит от его концентрации, но прямая линия не совпадает с линией, соответствующей закону Рауля. Давление пара растворенного вещества подчиняется закону Генри: парциальное давление пара растворенного вещества пропорционально его молярной доле:
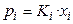 , (31)
, (31)
где xi – молярная доля i-го растворенного вещества; Ki – константа с размерностью давления, называемая коэффициентом (константой) Генри.
Дата добавления: 2016-06-18; просмотров: 3501;











