ДИАГРАММЫ СОСТОЯНИЯ РАСТВОР-ПАР ДЛЯ БИНАРНЫХ СИСТЕМ.
Диаграммой состояния называется график, выражающий зависимость состояния от внешних условий или от состава системы. Обычно для описания состояния растворов используют диаграммы Ткип – x (температура кипения – состав) при р = const или р – x (давление пара – состав) при Т = const. Рассмотрим случай, когда раствор образован двумя летучими жидкостями.
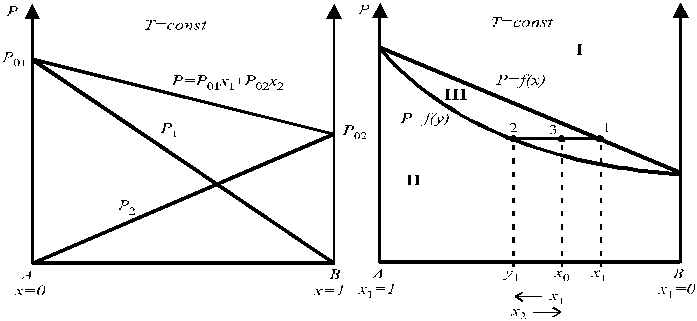
Зависимость давления паров от состава идеального жидкого раствора представлена на рис. 4, а зависимость общего давления пара от состава идеального раствора (прямая линия) и от состава пара (выпуклая вниз кривая) — на рис. 5.
Рис. 4. Зависимость давления паров от состава Рис. 5. Зависимость общего давления пара
идеального жидкого раствора. от состава идеального раствора
и состава пара.
Любая точка на диаграмме состояния носит название фигуративной. Точки 1 и 2 на рис. 5 характеризуют состав находящихся в равновесии жидкой и паровой фаз, соответственно. Точка 3 характеризует валовый (общий) состав системы. В области I диаграммы существует только жидкий раствор, в области II — только пар, в области III жидкая и паровая фазы сосуществуют. Кривая p = f (x) называется линией жидкости и выражает зависимость давления пара над раствором от состава жидкого раствора. Кривая p = f (y) называется линией пара и выражает зависимость давления пара над раствором от состава пара.
Интересно отметить, что даже в случае образования идеальных растворов состав пара не совпадает с составом жидкого раствора. Так, парциальное давление растворителя в паре над раствором по закону Рауля равно
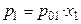 . (34)
. (34)
С другой стороны, из закона Дальтона следует, что
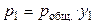 , (35)
, (35)
где робщ. — общее давление пара над раствором, y1 — мольная доля растворителя в паре. Тогда
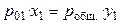 , (36)
, (36)
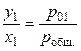 . (37)
. (37)
Поскольку давление пара над чистым растворителем (р01) всегда больше общего давления пара для случая, представленного на рис. 5, то y1 > x1 во всей области концентраций. Пар обогащен растворителем по сравнению с жидким раствором.
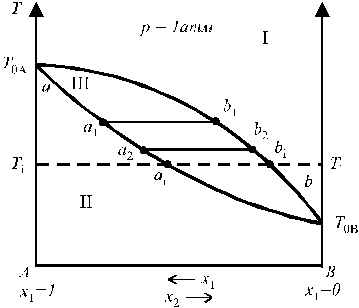 |  | ||
Зависимость температуры кипения от состава раствора и пара представлена на рис. 6. В области I диаграммы существует только пар (газовый раствор), в области II — только жидкий раствор; область III является областью сосуществования пара и жидкого раствора. Кривая aa1a2…b называется кривой кипения;кривая ab1b2…b — кривой конденсации; T0A и T0B — температуры кипения чистых жидкостей А и В (более летучим компонентом является В, так как T0A > T0B).
Рис. 6. Зависимость температуры кипения Рис. 7. Диаграмма состояния бинарного
от состава раствора и пара. раствора при применении к ней
правила рычага.
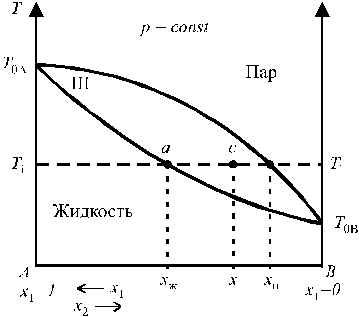
Температурой кипения раствора или чистой жидкости называют температуру, при которой давление пара равно внешнему давлению. Состав фаз при любой температуре определяется пересечением изотермы Ti = const с кривыми кипения и конденсации в точках ai и bi, а соотношение между количествами фаз, сосуществующих в равновесии, подчиняется правилу рычага.
Правило рычага:массы находящихся в равновесии фаз обратно пропорциональныотрезкам, на которые фигуративная точка системы делит прямую, соединяющую фигуративные точки фаз:
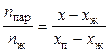 . (38)
. (38)
При этом если на диаграмме состояния состав задан в массовых долях, то и массы фаз выражаются в массовых единицах (кг и т.д.); если же состав задается в мольных долях, уравнение (5.38) определяет отношение чисел моль компонентов.
Дата добавления: 2016-06-18; просмотров: 5154;











