Изменение термодинамических функций при образовании растворов. Уравнение Гибса-Дюгема.
Процесс растворения твердых веществ в жидкостях с образованием истинных растворов можно мысленно разбить на три стадии:
1) ориентация полярных частиц (молекул) растворителя вокруг частиц растворяемого вещества (DН1 > 0);
2) разрушение кристаллической решётки (DН2 > 0);
3) сольватация частиц растворенного вещества в растворе (DН3 < 0).
Суммарный тепловой эффект образования раствора равен:
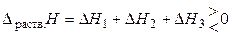 . (7)
. (7)
Образование растворов при смешении двух (и более) жидкостей или растворении газа (газов) в жидкости также сопровождается тепловыми эффектами, связанными с ослаблением связей между частицами растворителя и появлением новых связей между частицами растворителя и растворенных веществ.
Образование любого раствора — процесс самопроизвольный и всегда сопровождается увеличением энтропии: DраствS = DmixS > 0. При образовании идеального раствора не происходит выделение тепла и изменения объёма. Поэтому функции смешения для бинарного идеального раствора (образование раствора происходит при постоянной температуре) равны:
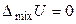 , (8)
, (8)
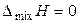 , (9)
, (9)
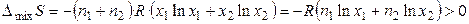 , (10)
, (10)
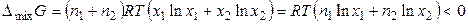 , (11)
, (11)
где n1 и n2 – число молей растворителя и растворенного вещества, x1 и x2 — мольные доли растворителя и растворенного вещества.
Для любого раствора справедливо:
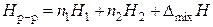 , (12)
, (12)
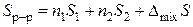 , (13)
, (13)
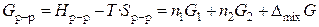 . (14)
. (14)
Известно, что в химической термодинамике одной из важнейших величин является химический потенциал (парциальная мольная энергия Гиббса), определяемая по уравнению:
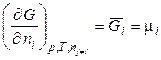 . (15)
. (15)
При постоянных р и Т справедливо:
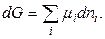 (16)
(16)
С другой стороны, суммарная энергия Гиббса системы равна
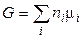 . (17)
. (17)
Продифференцируем уравнение (17):
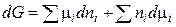 . (18)
. (18)
Сравнивая (16) и (18), получаем
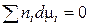 . (19)
. (19)
Уравнение (19) получило название уравнение Гиббса-Дюгемаи широко используется в термодинамике растворов.
Дата добавления: 2016-06-18; просмотров: 2421;











