ЭБУЛИОСКОПИЯ. КРИОСКОПИЯ.
1. Эбулиоскопия — метод определения молекулярных масс по повышению точки кипения раствора. Температурой кипения раствора называют температуру, при которой давление пара над ним становится равным внешнему давлению.
Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т0). Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества.
Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. Можно показать, что в случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению
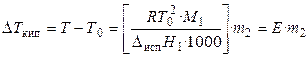 , (32)
, (32)
где М1 — молярная масса растворителя, DиспН1 — энтальпия испарения растворителя, m2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя); Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества.
2. Криоскопия – метод определения молекулярных масс по понижению температуры замерзания раствора. При охлаждении растворов наблюдается их замерзание. Температура замерзания – температура, при которой образуются первые кристаллы твердой фазы. Если эти кристаллы состоят только из молекул растворителя, то температура замерзания раствора (Т) всегда ниже температуры замерзания чистого растворителя (Тпл). Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора.
Количественная зависимость понижения температуры замерзания от концентрации раствора выражается следующим уравнением:
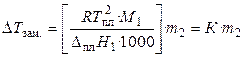 , (33)
, (33)
где М1 — молярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.
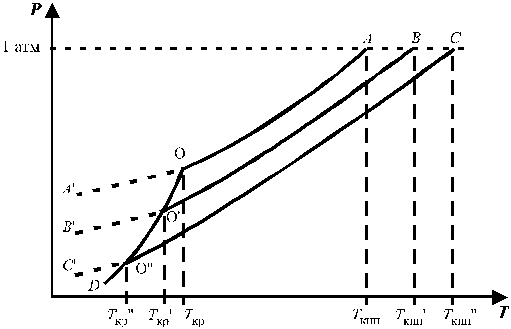 |
На рис. 3 представлена температурная зависимость давления насыщенного пара над чистым жидким и твердым растворителем (кривые ОА и ОD) и его парциального давления в паре над растворами разных составов (кривые ВО¢ и СО¢¢) для случая, когда растворенное вещество нелетуче. Кривые ОА¢, O¢B¢,O¢¢C показывают ход с температурой давления паров над переохлажденным и чистым растворителем (ОА¢) и растворами соответствующих составов (О¢B¢, O¢¢C).
Рис. 3. Зависимость давления насыщенного пара растворителя от температуры.
Кристаллы растворителя будут находиться в равновесии с раствором, если давления пара растворителя над твердой и жидкой фазами будут равны, т.е. когда кривая ОD пересечет кривые ВВ¢, CC¢ при соответствующих температурах Tкр¢ и Tкр¢¢. Температуры, отвечающие этому условию, будут ниже температуры замерзания чистого растворителя (Tкр – тройная точка растворителя).
Понижение точки замерзания и повышение точки кипения растворов, их осмотическое давление не зависят от природы растворенных веществ. Такие свойства называют коллигативными. Эти свойства зависят от природы растворителя и концентрации растворенного вещества. Как правило, коллигативные свойства проявляются, когда в равновесии находятся две фазы, одна из которых содержит растворитель и растворенное вещество, а вторая – только растворитель.
Дата добавления: 2016-06-18; просмотров: 3851;











