Виды конфигурационной стереоизомерии. Энантиомерия и диастереомерия. Относительная и абсолютная конфигурация. D,L– и R,S–системы стереохимической номенклатуры. Рацематы. Примеры.
Для органических веществ, помимо структурной изомерии (изомерии строения), возможна пространственная изомерия, или стереоизомерия. Молекулы существуют и вступают в химические превращения в трехмерном пространстве как стереоизомеры, в связи с чем особую важность приобретает знание их пространственного строения, что составляет предмет стереохимии.
Стереоизомсры — это соединения с одинаковым строением, т. е. одним п тем же порядком соединения атомов, но отличающиеся расположенное тех же атомов в пространстве. С позиции их относительной устойчивости стереоизомеры разделяют на конфигурационныеиконформационные.
Конфигурационные стереоизомеры характеризуются тем, что могут существовать в виде индивидуальных форм, т. е. обладают определенной конфигурационной устойчивостью. Каждый из них может быть выделен в виде самостоятельно существующего вещества, имеющего набор определенных физических и химических свойств, отличных от свойств другого стереоизомера.
Конформационные стереоизомеры, или просто конформации, чаще всего возникают в результате вращения отдельных фрагментов молекул вокруг простых связей. Конформации могут существовать только все вместе в виде единого множества геометрических форм молекулы с различным взаимным расположением в пространстве отдельных атомов и атомных групп.
С позиции представлений симметрии все стереоизомеры разделяют на энантиомерыидиастереомеры. Понятия диастереомерии и энантиомерии являются взаимоисключающими, следовательно, других типов стереоизомеров, имеющих разные симметрийные характеристики, существовать не может в принципе.
Энантиомеры — это стереоизомеры, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное изображение. Диастереомеры — это стереоизомеры, молекулы которых не относятся друг к другу как предмет и несовместимое с ним зеркальное изображение.
В виде энантиомеров могут существовать только те соединения, молекулы которых хиральны. Энантиомеры имеют одинаковые физические и химические свойства, физические константы (температуры плавления и кипения, плотность, растворимость, показатель преломления и др.), с равными скоростями вступают в одни и те же реакции, если действующие на них реагенты ахи- ральны. Различаются энантиомеры знаком оптической активности.
Смесь равных количеств двух энантиомеров называется рацематом. Рацематы не обладают оптической активностью. Строго говоря, различают истинные рацематы, представляющие собой молекулярные соединения двух энантиомеров, и рацемические смеси — смешанные кристаллы или конгломераты отдельных энантиомеров. Для простоты далее будет использоваться только термин рацемат. Рацемические формы обозначают знаком (±).
Важно отметить, что рацемическая смесь, как любая смесь двух веществ, имеет температуру плавления и ряд других физических свойств, отличных от свойств каждого из ее компонентов. Тем более это относится к истинному рацемату, являющемуся фактически индивидуальным соединением. Константа кислотности, которая характеризует свойства молекул в растворе, одинакова для рацемата и для каждого энантиомера в отдельности.
Рацематы образуются в химических реакциях, протекающих в ахиральной среде и приводящих к возникновению центра хиральности в исходных ахиральных молекулах. При этом в реакционной среде должны отсутствовать какие-либо факторы (хиральный растворитель, хиральный катализатор или фермент и т. п.), способствующие предпочтительному образованию одного из двух энантиомеров.
Индивидуальные энантиомерные формы могут подвергаться рацемизации, т. е. превращаться в рацемическую смесь. Рацемизация напрямую связана с конфигурационной устойчивостью энантиомеров: чем ниже устойчивость, тем с большей скоростью и в более мягких условиях протекает рацемизация. Рацемизация соединений с конфигурационно устойчивым 12С* происходит в результате химических реакций, и сопровождается образованием ахиральных интермедиатов, например карбокатионов. Рацемизация оптически активных соединений со сравнительно невысокой конфигурационной устойчивостью часто происходит в результате конформационных превращений.
Для обозначения конфигурации 12С*в хиральных молекулах в настоящее время используется R,S-система. В ее основе лежит принцип старшинства заместителей, окружающих центр хиральности, или, как его называют, правило последовательности. Для установления порядка старшинства лигандов руководствуются правилами:
· Старшинство заместителей определяется по порядковому номеру элемента, связанного непосредственно с центром хиральности. Чем больше номер элемента в периодической системе элементов, тем старше заместитель.
· Неподеленная пара электронов считается самым младшим заместителем.
· В более сложных случаях старшинство групп, окружающих центр хиральности, определяют по второму, третьему и более дальним слоям атомов. Например, группа — СН2ОН старше группы — СН2СН3. Это записывается так: С(О,Н,Н), атомы в скобках в порядке уменьшения их атомных номеров. В приведенных ниже примерах старшая группа записана слева:
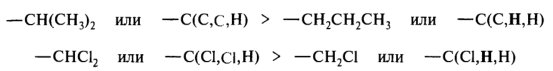
· В тех случаях, когда атом углерода имеет кратные связи с атомами последующего слоя, формально полагают, что он связан с двумя или соответственно тремя атомами этого вида:
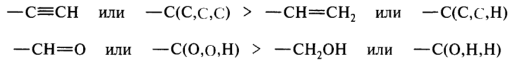
· Группы с реально существующими атомами старше тех группировок, где такие же атомы появляются за счет двойных или тройных связей. Так, группа — СН(ОСН3)2 имеет приоритет перед группой —СН=О.
· Из двух изотопов старше тот, у которого больше массовое число, например, дейтерий D (2Н) старше протия 1Н.
· Заместитель с R-конфигурацией старше заместителя с S-конфигурацией, а группировка атомов с Z-конфигурацией двойной углерод-углеродной связи старше, чем группа с E-конфигурацией.
После ранжирования лигандов молекулярную модель располагают в пространстве таким образом, чтобы младший из четырех заместителей был удален от глаза. Если при этом старшинство трех оставшихся снижается по часовой стрелке, центру хиральности приписывают R-конфигурацию. Если падение старшинства происходит против часовой стрелки, конфигурацию 12С* обозначают буквой S.
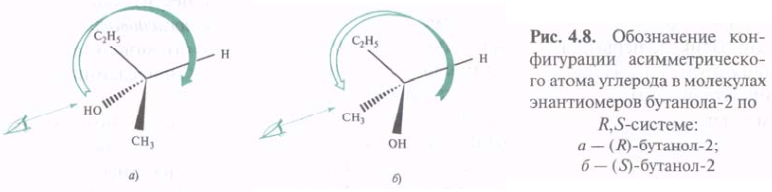
Для запоминания взаимосвязи R,S-обозначений с направлением падения старшинства лигандов рекомендуется мнемоническое правило: падение старшинства по часовой стрелке совпадает с направлением написания верхней части буквы R, а падение старшинства против часовой стрелки совпадает с направлением написания верхней части буквы S.
Обозначение конфигурации хиральных центров можно провести с применением проекционных формул Фишера. Для этого проекцию преобразуют так, чтобы младший заместитель IV разместился на одной из вертикальных связей, что соответствует положению заместителя за плоскостью чертежа. Если после преобразования проекции падение старшинства остальных трех группировок (I—III) происходит против часовой стрелки, то 12С*приписывают S- конфигурацию, в противоположном случае — R-конфигурацию:
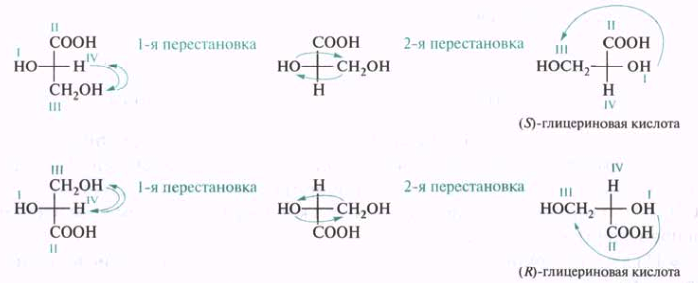
D,L-Система обозначения конфигурации. Проблема, заключалась в том, что технические возможности времени не позволяли установить абсолютную конфигурацию (истинное взаимное расположение атомов в молекуле). Было найдено решение — левовращающему глицериновому альдегиду была произвольно приписана формула (I), а правовращающей форме — структура (II):
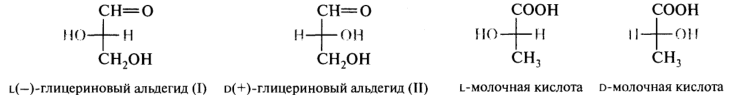
Согласно этой концепции, конфигурацию других хиральных молекул сравнивают с конфигурацией одного из энантиомеров глицеринового альдегида. Соединения, имеющие конфигурационное сходство с оптически активным левовращающим глицериновым альдегидом, относят к L-стереохимическому ряду, и соответственно соединения, в которых расположение атомов и атомных групп похоже на конфигурацию правовращающего глицеринового альдегида, относят к D-ряду.
Абсолютная конфигурация одного из известных ранее оптических веществ — D-винной кислоты — была определена методом рентгеноструктурного анализа при изучении дифракции рентгеновского излучения на кристаллах смешанной натриеворубидиевой соли D-винной кислоты. К счастью, она оказалась такой же, какую для нее установили путем химической корреляции с глицериновым альдегидом. Следовательно, и конфигурации остальных веществ, соотнесенные ранее с винной кислотой, оказались истинными, что позволило избежать путаницы в литературе. В настоящее время рентгеноструктурный анализ является одним из основных методов установления пространственного строения органических молекул.
Однако D,L-система имеет ограниченное применение из-за невозможности отнесения к D- или L-рялу соединений многих классов. При отнесении к стереохимическим рядам стереоизомеров, имеющих два и более центра хиральности, приходится вводить некоторые оговорки. В настоящее время D,L-система находит применение в основном в химии углеводов, аминокислот и родственных с ними соединений.
Дата добавления: 2016-06-18; просмотров: 4141;











