Типы органических оснований. Факторы, определяющие основность. Примеры.
Среди оснований Брёнстеда анионы по сравнению с нейтральными молекулами, как правило, обладают более сильно выраженными основными свойствами. Например, амид-ион NH2-, гидроксид-ион НО- и алкоксид-ион RO- по основности превосходят аммиак NH3, воду Н2О и спирт ROH соответственно. Перечисленные ионы являются очень сильными основаниями. В результате присоединения протона к нейтральному основанию образуются солеобразные ониевые соединения:
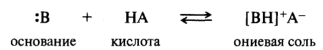
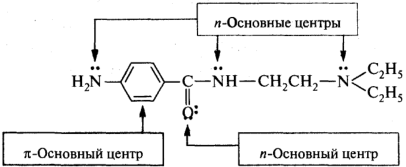
В зависимости от природы гетероатома получаются соли: аммониевые (центр основности — атом азота), оксониевые (атом кислорода) и сульфониевые (атом серы). На примере молекулы новокаинамида:
Сила основания определяется как доступностью пары электронов гетероатома, так и стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание. Для качественной оценки основности органических оснований привлекаются те же факторы, что и для оценки кислотности с той разницей, что влияние этих факторов на стабильность катиона противоположно (за исключением сольватации) тому влиянию, которое эти факторы оказывают на стабильность аниона.
Основность соединений с разными гетероатомами в центре основности, но с одинаковыми заместителями при нем, зависит от электроотрицательности и поляризуемости элемента в основном центре. Из двух элементов второго периода — азота и кислорода — электроотрицательность больше у кислорода, поэтому он прочнее удерживает неподеленную пару электронов и менее склонен присоединять протон по сравнению с азотом. Амины являются более сильными основаниями, чем спирты. У элементов третьего периода — серы и фосфора — электронная плотность неподеленной пары электронов рассредоточена в большем объеме (фактор поляризуемости). Эти атомы слабее связывают протон, поэтому тиолы, как правило, более слабые основания, чем спирты и тем более чем амины. В целом сила n-оснований с одинаковыми заместителями при гетероатоме уменьшается в следующем порядке:
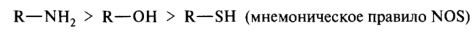
Наибольшая основность среди органических соединений характерна для алифатических аминов, значения рKвн+ которых находятся в диапазоне 9 - 11 единиц. При взаимодействии с кислотами амины превращаются в аммониевые соли. Под действием более сильного основания аммониевые соли депротонируются с освобождением исходного амина:
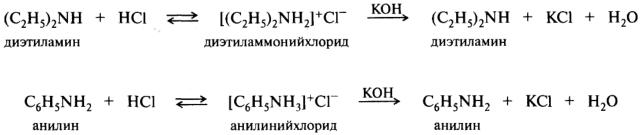
Перевод водонерастворимых органических оснований в растворимые соли часто служит способом выделения таких оснований из смесей и их очистки.
У спиртов, простых и сложных эфиров, альдегидов, кетонов, карбоновых кислот значения pKBH+ лежат в диапазоне от - 2 до – 7. Это очень слабые основания, могут протонироваться только сильными кислотами. Образующиеся оксониевые соли легко гидролизуются избытком воды до исходных соединений:
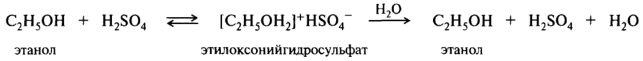
Серосодержащие n-основания еще слабее кислородсодержащих.
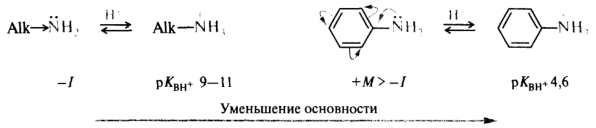
Основность соединений с одинаковыми гетероатомами в центре основности определяется доступностью электронной пары гетероатома для связи с протоном, электронным влиянием заместителей и эффектом сольватации. В ароматических аминах аминогруппа находится в p,π-сопряжении с π-электронами бензольного кольца, что приводит к делокализации неподеленной пары электронов по общей сопряженной системе. В этом случае атом азота становится менее склонным к образованию ковалентной связи с протоном, и поэтому ароматические амины более слабые основания, чем алифатические. Кроме того, катионы ароматических аминов вследствие большого размера ароматического радикала плохо сольватируются в протонсодержащих растворителях.
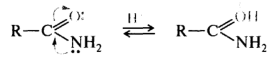
В амидах карбоновых кислот участие неподеленной пары электронов атома азота в p,π-сопряжении с акцепторной карбонильной группой приводит к тому, что более сильным основным центром становится атом кислорода:
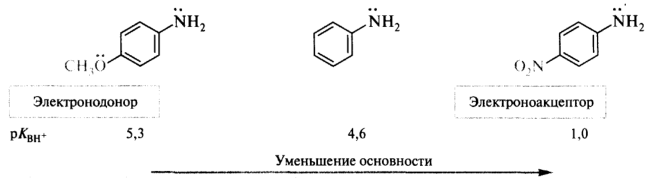
Влияние заместителей на собственную основность, т. е. основность в газовой фазе, подчиняется следующим закономерностям: (!) электронодонорные заместители повышают основность, электроноакцепторные — понижают.
Алифатические амины, содержащие электронодонорные алкильные группы у атома азота, более сильные основания, чем аммиак, и наоборот, из-за наличия сильных электроноакцепторных трифторометильных групп перфторотриметиламин практически не проявляет основных свойств:
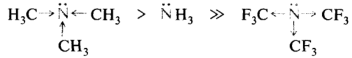
Сольватация может оказывать сильное воздействие на собственную основность алифатических аминов. Однако в ароматических аминах, размеры катионов которых не различаются слишком сильно, электронные эффекты заместителей вносят главный вклад в стабилизацию катиона и, следовательно, определяют силу оснований:
Многие соли органических оснований, особенно гидрохлориды, растворимы в воде. Поэтому лекарственные органические вещества часто используются в виде солей.
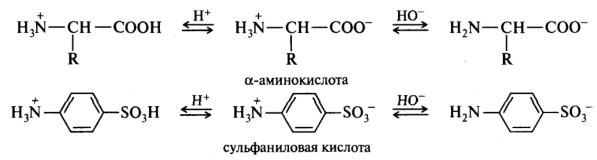
Некоторые органические соединения обладают одновременно и кислотными, и основными свойствами, т. е. являются амфотерными. В зависимости от соотношения силы кислотного и основного центров это может приводить либо к образованию внутренней соли (полный перенос протона), либо к образованию водородных связей внутри молекулы или между молекулами. Например, амфотерными соединениями являются спирты, амиды, аминокислоты, аминосульфоновые кислоты:
Дата добавления: 2016-06-18; просмотров: 4103;











