Классификация органических реакций и реагентов. Примеры.
В процессе химических реакций происходит разрыв одних и образование новых химических связей с перераспределением электронной плотности атомов реагирующих веществ. Атом или группу атомов, участвующих в разрыве или образовании связей, называют реакционным центром. Способность соединения вступать в ту или иную химическую реакцию и реагировать с той или иной скоростью служит характеристикой его реакционной способности.
Реакционная способность соединения всегда должна рассматриваться только по отношению к партнеру. Для удобства одно из реагирующих соединений обозначают как субстрат, а действующее на него соединение как атакующий реагент. В органической химии субстратом называют то соединение, молекула которого поставляет для образования новой связи атом углерода. Для классификации органических реакций используют следующие признаки:
• характер изменения связей в реагирующих веществах;
• направление реакции;
• число молекул, принимающих участие в стадии, определяющей скорость реакции.
Характер изменения связей в субстрате и реагенте. По этому признаку реакции подразделяют на радикальные, ионные и согласованные.
Радикальные реакции. При гемолитическом разрыве ковалентной связи образуются радикальные реагенты, имеющие по одному неспаренному электрону:
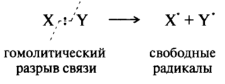
Свободный радикал — это атом или группа атомов с неспаренным валентным электроном. Примеры радикальных реагентов - атомы галогенов Br•, Cl•, гидроксильные НО•, гидропероксильные НОО•, алкилпероксильные ROO• и алкильные R•. Наличие неспаренного электрона служит причиной низкой стабильности и высокой реакционной способности. Высокая реакционная способность объясняется стремлением достроить внешний электронный уровень до устойчивого октета. Однако существуют и относительно стабильные свободные радикалы, у которых имеется возможность делокализации неспаренного электрона по системе сопряженных кратных связей, например, трифенилметильный (С6Н5)3С• бензильный С6Н5СН2• и аллильный СН2=СН—СН2•.
Ионные реакции. При гетеролитическом разрыве ковалентной связи пара электронов отходит к одному из партнеров по связи. При этом образуются электрофильные и нуклеофильные частицы:
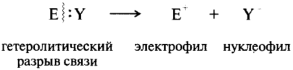
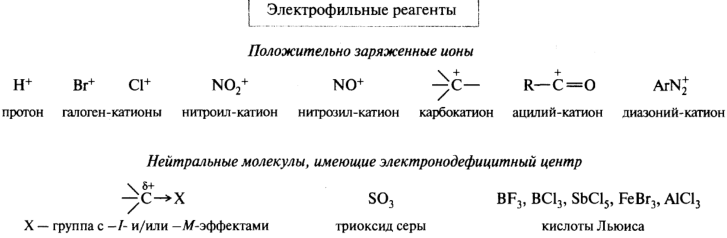
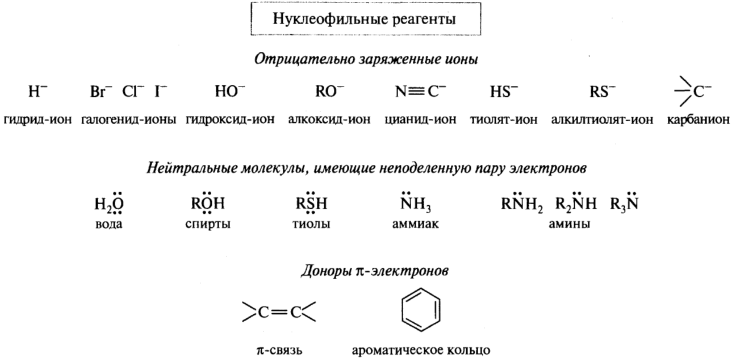
Электрофильные реагенты — это частицы, образующие новые ковалентные связи за счет пары электронов партнера (обозначаются символами Е или Е+). Нуклеофильные реагенты — это частицы, образующие новые ковалентные связи со своим партнером, предоставляя для этого пару электронов (обозначаются символами Nu или Nu-).
Электрофильные и нуклеофильные частицы могут участвовать в реакциях и в качестве промежуточных частиц — ионных интермедиатов.
Согласованные (синхронные) реакции. В данных реакциях разрыв старых и образование новых связей происходит одновременно без участия радикальных или ионных частиц. Эти реакции протекают через циклическое переходное состояние. Реакции такого типа называют перициклическими.
Направление реакции. По направлению процесса органические реакции делят на несколько основных типов.
Реакции замещения. Их обозначают символом S (от англ. substitution). Замещение в зависимости от природы атакующего реагента может быть радикальное, электрофильное или нуклеофильное:
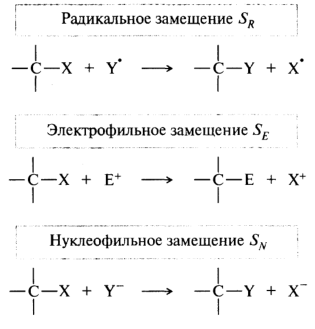
Замещаемая часть субстрата X называется уходящей группой. Группа, уходящая без пары электронов, называется электрофугом; уходящая с парой электронов — нуклеофугом. При радикальном замещении уходящий свободный радикал тут же вступает в дальнейшую реакцию.
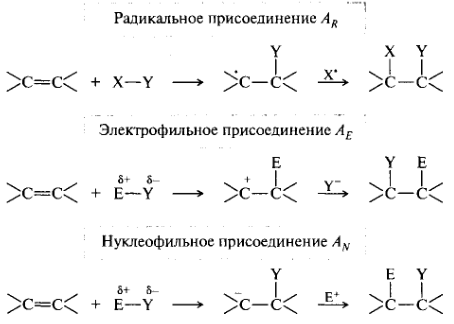
Реакции присоединения. Эти реакции обозначают символом А (от англ. addition). Присоединение к кратным связям может происходить по трем возможным механизмам (на примере связи С=С):
Реакции отщепления (элиминирования). Их обозначают символом Е (от англ. elimination). Как правило, эти реакции осуществляются как β-элиминирование, когда отщепляющиеся группы уходят от соседних атомов углерода. Группы X и Y могут уходить последовательно или одновременно, они могут объединяться либо не объединяться.
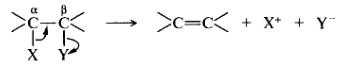
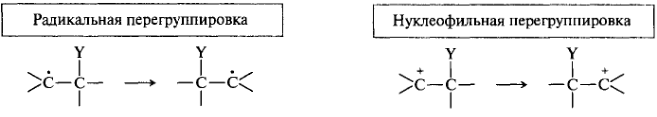
Перегруппировки. В процессе перегруппировок происходит переход (миграция) атомов или групп от одного атома к другому. Наиболее распространенный вид перегруппировок — 1,2-перегруппировки (1,2-сдвиги). В этом случае мигрирующая группа переходит к соседнему атому. Мигрирующая группа может переходить с одним или парой электронов:
Перициклические реакции. Образование связей по концам реагирующих молекул происходит согласованно с одновременным перераспределением π-связей внутри циклического переходного состояния. К перициклическим реакциям относятся циклоприсоединение, электроциклические реакции, сигматропные перегруппировки, реакции переноса групп.
В процессе циклоприсоединения две ненасыщенные молекулы соединяются с образованием циклического аддукта с перераспределением и общим уменьшением кратности связей:
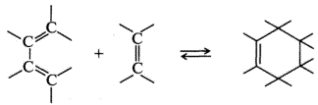
Реакция, обратная циклоприсоединению, называется циклораспадом.
В электроциклических реакциях циклизация включает образование σ-связи между концами сопряженной линейной π-электронной системы:
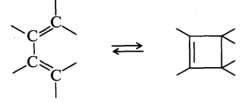
Сигматропные перегруппировки включают разрыв σ-связи в исходной молекуле и образование новой σ-связи между ранее несвязанными атомами:
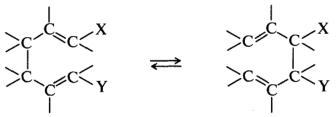
В реакциях переноса групп происходит синхронный обмен связей по кольцу. Уходящие группы образуют новую молекулу с углерод-углеродной связью, а в исходном субстрате происходит повышение кратности связи:
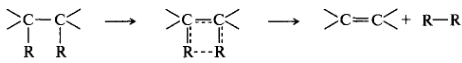
Окислительно-восстановительные реакции. В ходе этих реакций меняется степень окисления атома углерода, выступающего в роли реакционного центра. Процесс окисления включает переход электронов от органического субстрата к реагенту-окислителю, а процесс восстановления — передачу электронов реагента органическому субстрату. Окислительно-восстановительный характер органических реакций выявляется не так наглядно, как в неорганических. В некоторых реакциях происходит прямой перенос электронов, тогда как механизм других не включает стадии непосредственного переноса электронов. В классификации таких реакций учитывается изменение степени окисления атома углерода, являющегося реакционным центром.
Окисление органических соединений — это процесс удаления водорода с образованием кратной связи иди новой связи между 12C и гетероагомом более электроотрицательным, чем водород. Восстановление — это процесс, обратный окислению. Окислительно-восстановительный ряд показан на примере последовательного окисления метана в диоксид углерода:
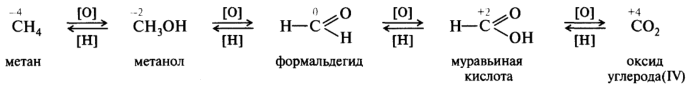
Механизм конкретной реакции окисления или восстановления может существенно изменяться в зависимости от природы окислителя или восстановителя. Существуют разные способы передачи электронов от одной молекулы к другой:
• прямой перенос электрона, когда источником электронов служит металл или ион металла (например, Fe2+ —» Fe3+). К этому способу относится окисление свободных радикалов до положительного иона или восстановление радикалов до отрицательного иона, а также реакции электролитического восстановления или окисления;
• гидридный перенос, когда передача электронов происходит путем переноса гидрид-иона Н- от субстрата или к нему. Примером такой реакции является восстановление альдегидов и кетонов с помощью алюмогидрида лития или борогидрида натрия;
• перенос 1Н, представляющий собой свободнорадикальный разрыв связи R—Н и соответствующий перенос Н•;
• прямое взаимодействие органического субстрата с кислородом, приводящее к получению продукта с ковалентно связанным кислородом. Формальным примером может служить алифатическое гидроксилирование:
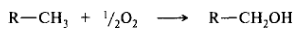
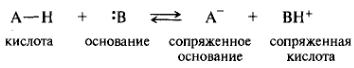
Кислотно-основные взаимодействия. К ним относятся широко распространенные обратимые реакции ионной диссоциации:
Молекулярность реакций. По числу частиц, принимающих участие в скоростьопределяющей стадии реакции, органические реакции подразделяют на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные). Молекулярность реакции определяется либо числом частиц, претерпевающих разрыв и образование ковалентных связей, либо числом реагирующих частиц, необходимых для образования переходного состояния реакции.
Мономолекулярными являются процессы распада молекулы на составные части или превращения молекулы вещества А в молекулу вещества В. Примером мономолекулярных реакций служат реакции нуклеофильного замещения, осуществляемые по механизму SN1 (см. 13.4.2), и элиминирования по механизму Е1(см. 13.4.3). Бимолекулярными процессами являются реакции нуклеофильного замещения, протекающие по механизму SN2 (см. 13.4.2) и элиминирования по механизму Е2 (см. 13.4.3). Тримолекулярные реакции встречаются редко. Один из примеров таких реакций — гидрогалогенирование (см. 8.4.1).
Под механизмом реакции подразумевают детальное описание процесса, в результате которого исходные вещества превращаются в конечные продукты. При изучении механизма реакций устанавливается, каким образом осуществляется каждая из стадий процесса, как происходит разрыв старых и образование новых связей, каковы состав и строение промежуточных частиц (интермедиатов), какое влияние оказывает растворитель (среда) на протекание реакций. Механизм реакции должен согласовываться с термодинамикой, кинетикой и стереохимией процесса. Его следует рассматривать как более или менее вероятную гипотезу, объясняющую экспериментальные факты. С появлением новых данных и сведений о более тонких деталях протекания реакции понимание механизма может претерпевать изменения.
Дата добавления: 2016-06-18; просмотров: 8721;











