Кислотные и основные свойства органических молекул; теории Бренстеда и Льюиса. Примеры.
Кислотность и основность — важнейшие понятия, определяющие многие фундаментальные физико-химические свойства и биологическую активность органических соединений. В органической химии существует несколько концепций кислот и оснований. Общепринятой является протолитическая теория Брёнстеда—Лоури (1923). Почти одновременно Г. Льюис предложил более общую концепцию кислот и оснований, на основе которой в дальнейшем Р. Пирсон (1963) разработал принцип жестких и мягких кислот и оснований.
Кислотность и основность по Брёнстеду-Лоури.В соответствии с теорией Брёнстеда-Лоури кислотность и основность соединений связывают с переносом протона Н+.
Кислоты — вещества, способные отдавать протон (доноры прогона); основания — вещества, способные принимать протон (акцепторы протона). Кислота и основание образуют сопряженную кислотно-основную пару. Кислотные свойства проявляются в присутствии основания, основные — в присутствии кислоты.
В общем виде кислотно-основное взаимодействие описывается уравнением
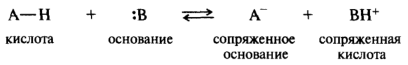
В принципе большинство органических соединений можно рассматривать как потенциальные кислоты, поскольку в них содержатся атомы водорода, связанные с разными элементами (О, S, N, С). Элемент и связанный с ним атом водорода называют кислотным центром. Органические кислоты соответственно классифицируют по кислотному центру как ОН-, SH-, NH- и СН-кислоты. Кислотами могут быть не только нейтральные молекулы, но и положительно заряженные ионы, а также диполярные ионы. Органические основания для образования ковалентной связи с протоном кислоты должны либо иметь неподеленную пару электронов у гетероатома (нейтральные молекулы), либо быть анионами. В целом основания, имеющие в молекулах гетероатом, называются n-основаниями. Существует еще одна группа оснований — π-основания, в которых центром основности являются электроны локализованной π-связи или π-электронного облака сопряженной системы. π-Основания образуют с протоном не ковалентные связи, а короткоживущие π-комплексы.
Кислотность и основность веществ по Брёнстеду-Лоури характеризуется количественно. Применяя закон действующих масс, можно выразить кислотные свойства кислоты А—Н через константу равновесия Kp, представленной выше реакции обратимого кислотно-основного взаимодействия:
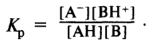
Очевидно, что константа равновесия реакции ионизации кислоты имеет постоянное значение только для данной системы и по отношению к каждому основанию существует своя шкала констант кислотности. Наиболее важным случаем является ионизация кислот в водном растворе (вода играет роль основания):

Поскольку вода присутствует в большом избытке, то ее концентрация остается практически постоянной, равной 55,5 моль/л. Это значение включают в константу равновесия и получают характеристику, называемую константой кислотности Ка:
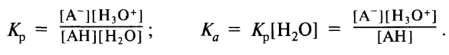
Чем больше Ка, тем сильнее кислота. Однако даже такая сравнительно сильная по меркам органических соединений кислота, как уксусная, имеет Ка= 1,75 • 10-5. Для большинства органических соединений Ка имеют еще меньшие значения. Поэтому для оценки силы органических кислот значительно удобнее пользоваться значениями рКапредставляющими собой отрицательный логарифм констант кислотности: рКа = -lgКа. При этом чем меньше рКа, тем сильнее кислота. Кислоты, у которых рКа > 7, не изменяют цвет нейтральной индикаторной бумаги; кислоты с рКа >10 не имеют кислого вкуса.
Основность соединений в водном растворе можно охарактеризовать величиной рКb, которая связана с рКа через ионное произведение воды: рКb = 14 - рКа. Однако в настоящее время для характеристики основности чаще используют величину рКасопряженной основанию В кислоты ВН+, обозначаемую как рKBH+. Такой подход позволяет применять одну и ту же шкалу для характеристики ионизации как кислот, так и оснований. В этом случае чем больше pKBH+, тем сильнее основание.
Слабые кислоты и основания в биологических системах. Большинство биологически активных органических соединений, в частности лекарственных веществ, являются слабыми кислотами или основаниями. Степень ионизации таких соединений в той или иной среде имеет важное значение для проявления биологического действия. Известно много лекарственных веществ, терапевтическая активность которых определяется долей присутствующих неионизированных молекул, хотя существуют и другие примеры, когда, наоборот, ионизированная часть вещества обусловливает биологический эффект за счет взаимодействия с катионными или анионными центрами рецепторов. Различия в степени ионизации обеспечивают избирательность действия, и это связано с такими факторами, как, например, проникновение через мембраны в плазму крови или клетку, адсорбцией на поверхностях ферментов, возможной ионизацией центров рецептора в зависимости от pH и т. д.

Степень ионизации органических кислот и оснований в растворе определяется значениями двух параметров: pH раствора и рКа кислоты (или рКBH+ основания). Если значения рКа (или pKBH+) вещества и pH раствора известны, то степень ионизации может быть рассчитана следующим образом:

Степень ионизации имеет важное значение для процессов проникновения веществ через различные мембраны в организме, например при всасывании (абсорбции) лекарств из желудочно-кишечного тракта. Мембраны эпителия пищеварительного тракта можно рассматривать как липидный бислой, в который встроены белковые молекулы. Гидрофобные участки мембранных белков погружены во внутреннюю полость мембраны, а ионизированные участки обращены к водной фазе внутри и снаружи. Согласно классической теории, мембраны подобного типа препятствуют прохождению ионов, так как, во-первых, ионы вследствие гидратации имеют относительно большой размер и, во-вторых, если заряд иона и заряд белковой поверхности, к которой он приближается, аналогичны по знаку, то происходит отталкивание, а если противоположны, то происходит адсорбция иона на поверхности мембраны. Через природные мембраны проникают только те ионы, для которых существуют специфические транспортные системы или переносчики. Нейтральные липидорастворимые молекулы проникают через мембраны и тем быстрее, чем выше их липофильные свойства. Таким образом в желудочно-кишечном тракте происходит всасывание неионизированных молекул лекарственных веществ.
Препараты кислотной природы будут лучше всасываться из желудка (pH 1—3), а всасывание лекарств-оснований будет происходить только после того, когда они пройдут из желудка в кишечник (содержимое тонкого кишечника имеет pH 7—8). В течение одного часа из желудка крыс всасывается почти 60% ацетилсалициловой кислоты и только 6% анилина от введенной дозы. В кишечнике крыс всасывается уже 56% от введенной дозы анилина. Примечательно, что такое слабое основание, как кофеин (рKВH+ 0,8), всасывается за то же время в гораздо большей степени (36%), так как даже в сильнокислой среде желудка кофеин в значительной степени находится в неионизированном состоянии.
Эффективность действия лекарственных веществ обусловливается способностью их проникновения к рецептору. Дли веществ, способных к ионизации, биологическая активность может определяться долей неионизированных молекул или, наоборот, ионизированной частью вещества. Имеются многочисленные примеры и того, и другого вариантов. Так, и фенол и уксусная кислота прекращают рост различных плесневых грибов; их биологическое действие обусловлено неионтированными молекулами, и поэтому наибольшая эффективность уксусной кислоты проявляется при pH ниже 4, а для фенола при любых значениях pH ниже 9, так как в этих диапазонах значений pH и фенол и уксусная кислота находятся в неионизированном состоянии. Также только неионизированный теофиллин, в отличие от своего аниона, стимулирует деятельность сердца черепахи. На примере ряда сульфаниламидных препаратов, наоборот, установлено, что их антибактериальная активность обусловлена анионами. Оптимальное для проявления активности значение рКа сульфаниламидов находится в интервале 6—8. Через мембрану в клетку проникают неионизированные молекулы, но при физиологических значениях pH вновь образуются ионы, пока по обе стороны мембраны не установится равная степень ионизации:

Антибактериальная активность сульфаниламидов пропорциональна степени ионизации, но зависит также и от липофильности молекул.
И еще один пример, когда биологическая активность обусловлена ионизированной формой вещества: антибактериальное (бактериостатическое) действие аминоакридинов проявляется только в катионной форме этих соединений и возрастает при повышении степени их катионной ионизации. Изменение степени ионизации в зависимости от pH среды широко используют для выделения лекарственных веществ из биологических жидкостей (кровь, моча) с целью их последующего анализа, например, при проведении фармакокинетических исследований.
Кислоты и основания Льюиса. Согласно теории Льюиса, кислотно-основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием новой связи. Кислоты Льюиса — акцепторы пары электронов. Основания Льюиса доноры пары электронов.
Основания Брёнстеда и основания Льюиса являются донорами пары электронов — либо неподеленной, либо находящейся на р-орбитали, т. е. понятия тождественны в той и другой теории. Кислотность по Льюису имеет новый и более широкий смысл. Кислотой считается любая частица с вакантной орбиталью, которая способна дополнить свою электронную оболочку парой электронов. По Брёнстеду кислота — это донор протона, а по Льюису — сам протон Н+ является кислотой, так как имеет вакантную орбиталь.
Кислотами Льюиса являются галогениды элементов второй и третьей групп периодической системы (BF3, А1С13, FeCl3, FeBr3, ZnCl2 и др.). К кислотам Льюиса также относятся галогениды других элементов, имеющих вакантные орбитали — SnX4, SbX5, AsX5 и даже оксид серы (VI) SО3. Галогениды бора, алюминия имеют по шесть электронов на внешней оболочке и способны принимать пару электронов с образованием ковалентной связи. Тетрахлорид олова, например, имеет 8 электронов на внешней оболочке, но как элемент, имеющий вакантные орбитали, способен принять еще пару электронов. К кислотам Льюиса относятся также катионы металлов (Na+, Mg2+, Ag+), карбокатионы R3C+, нитроил-катион NО2+ и др. В гетеролитических реакциях кислоты Льюиса участвуют как электрофильные реагенты. Ниже приведены некоторые примеры взаимодействия между кислотами и основаниями Льюиса:
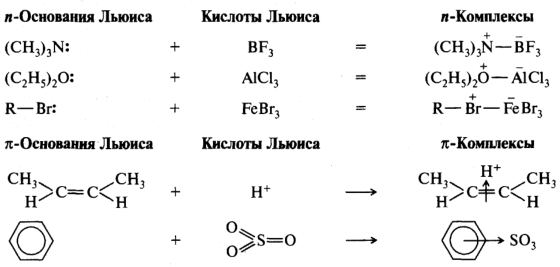
Многие распространенные органические реакции относятся к кислотноосновным взаимодействиям в рамках теории Льюиса. Однако в этой теории гораздо сложнее дать количественную оценку кислотности и основности, и такая оценка может быть лишь относительной. Для этого определяют энергии взаимодействия различных соединений в строго определенных условиях (растворитель, температура) с одним и тем же стандартом, являющимся соответственно кислотой или основанием Льюиса. Поэтому количественных измерений для кислот и оснований Льюиса сделано намного меньше, чем для кислот и оснований Брёнстеда.
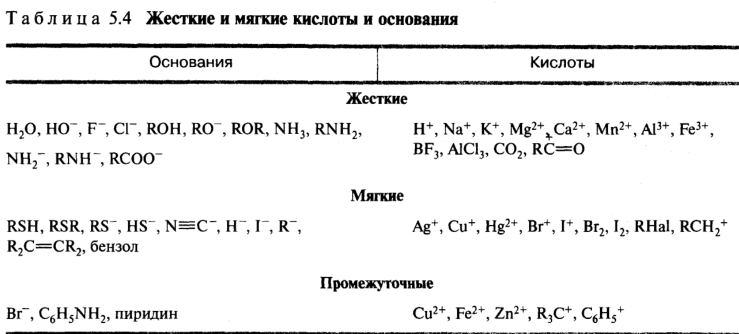
Жесткие и мягкие кислоты и основания. Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО, принцип Пирсона). Согласно принципу Пирсона, кислоты и основания подразделяются на жесткие и мягкие.
Жесткие кислоты — это кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Мягкие кислоты Льюиса содержат акцепторные атомы большого размера с малым положительным зарядом, небольшой электроотрицательностью и высокой поляризуемостью.
Низшая свободная молекулярная орбиталь (НСМО), которая участвует в связывании с орбиталью донора пары электронов, у жестких кислот имеет низкую энергию. Самой жесткой кислотой является протон. НСМО мягких кислот имеет высокую энергию. Мягкие кислоты содержат легко поляризуемые вакантные орбитали. Положительный заряд у атома — акцептора пары электронов мал вследствие делокализации или вообще отсутствует (так, мягкой кислотой является молекула иода).
Жесткие основания — это донорные частицы, обладающие высокой электроотрицательностью, низкой поляризуемостью, трудно окисляющиеся. Мягкие основания, напротив, — это донорные частицы с низкой электроотрицательностью, высокой поляризуемостью, довольно легко окисляющиеся. Термин «жесткое основание» подчеркивает, что соединение — донор пары электронов — прочно удерживает свои электроны. У жестких оснований высшая занятая молекулярная орбиталь (ВЗМО), которая участвует в связывании с орбиталью акцептора пары электронов, имеет низкую энергию (расположена близко к ядру атома). Атомами-донорами в жестких основаниях являются азот, кислород, фтор, хлор. Мягкие основания слабо удерживают свои валентные электроны, ВЗМО донора имеет высокую энергию. Донорами пары электронов выступают атомы углерода, серы, фосфора, иода.
Следует отметить, что понятия «жесткие» и «мягкие» кислоты и основания не равноценны понятиям «сильные» и «слабые» кислоты и основания. Это две независимые характеристики кислот и оснований. Принцип ЖМКО используется для качественного описания эффективности протекания кислотно-основного взаимодействия: (!) жесткие кислоты лучше координируются с жесткими основаниями, мягкие кислоты — с мягкими основаниями. Концепция Пирсона основана на том, что взаимодействие между орбиталями с близкими энергиями более эффективно, чем между орбиталями, имеющими разную энергию.
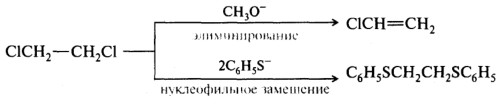
Действие принципа ЖМКО можно проиллюстрировать следующим примером. При взаимодействии галогеноалканов с нуклеофилами (являющимися также и основаниями) могут происходить конкурентные реакции — нуклеофильного замещения или элиминирования. Реакция нуклеофильного замещения осуществляется посредством взаимодействия нуклеофила с атомом углерода, связанным с галогеном. В реакции элиминирования происходит также и отщепление протона от соседнего атома углерода под влиянием основания.
При взаимодействии 1,2-дихлороэтана с жестким основанием (метоксид-ионом) вследствие атаки реагента на жесткую кислоту — протон преимущественно происходит реакция элиминирования. Мягкое основание — тиофеноксид-ион — предпочтительно реагирует с более мягкой кислотой — атомом углерода, в результате чего образуется продукт реакции нуклеофильного замещения:
Дата добавления: 2016-06-18; просмотров: 14694;











