Борный координационный эффект
Координационные числа бора по отношению к кислороду небольшие – к.ч.= 3 и 4. В обоих случаях катион В3+ является стеклообразователем.
В первом случае (к.ч.= 3) бор окружен тремя атомами кислорода. Возникают плоские равносторонние треугольники [ВО3]3- с атомом бора в центре треугольника.
Структура стеклообразного борного ангидрида В2О3 выполнена из треугольников [ВО3], соединённых вершинами. Основные структурные элементы этого стекла – бороксольные кольца.

В2О3 – трёхмерный каркас стекла формируют плоские треугольники ВО3, образующие бороксольные кольца.
SiO2 – трёхмерный каркас стекла формируют объёмные структурные элементы – тетраэдры [SiO4].
По сравнению с кремнезёмом, борный ангидрид имеет гораздо меньшую температуру плавления (≈ 450оС), несмотря на то, что по энергиям связи ЕSi-O= 1460 кДж/моль и ЕВ-О = 830 кДж/моль различие не столь существенно (рис.2.7).
Таблица 2.7.
Сопоставление свойств борного ангидрида и
диоксида кремния
| В2О3 | SiO2 |
| Тпл = 450˚С Тg= 280˚C Eη= 170 кДж/моль | Тпл = 1713˚С Тg= 1100˚C Eη= 760 кДж/моль |
Невысокая прочность структуры борного ангидрида обусловлена относительно слабыми молекулярными связями между бороксольными кольцами. Это один из редких примеров присутствия молекулярных сил в структуре стекла.
Координация к.ч.= 4 соответствует образованию группировок [ВО4]5-. Для построения тетраэдров [ВО4] на каждый ион бора требуется по два иона кислорода, так же как в кремнезёме SiO2. В борном ангидриде В2О3 на каждый атом бора приходится 1,5 атома кислорода. Недостающее количество ионов кислорода вносят в стекло оксиды-модификаторы Ме2О и МеО. Чем выше их концентрация в стекле, тем большая доля бора переходит в четверную координацию.
Устойчивой оказывается группировка [(ВО4)5-Ме+]4-:
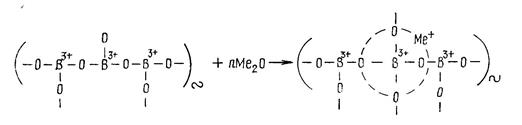
2(−В=) + Na2O → (≡В−О−В≡);
[ВО3] → [ВО4]
Исследование структуры методом ядерно-магнитного резонанса показало, в стекле Na2O∙B2O3 половина атомов бора находится в тройной координации, другая половина – в четверной координации (N3=0,5; N4=0,5). Появление группировок [(ВО4)5-Ме+]4- изменяет свойства стекла: растет температура ликвидуса, снижается коэффициент термического расширения (рис. 2.14).

Рис. 2.14. Влияние концентрации модификатора на коэффициент термического расширения стекла:
1 – Na2O-SiO2; 2 – Na2O-B2O3
В системе Na2O-SiO2 коэффициент термического расширения при введении модификатора монотонно возрастает, так как увеличивается число разрывов структурной сетки.
В системе Na2O-B2O3 возникают тетраэдры ВО4, структура уплотняется. Наиболее устойчивая структура – чередование тетраэдров и треугольников. Предельная концентрация бора в четверной координации соответствует окружению каждого тетраэдра ВО4 четырьмя треугольниками ВО3. Дальнейший рост содержания Na2O ведёт к разрыву структурной сетки с образованием немостиковых атомов кислорода на группировках ВО3.
Дата добавления: 2018-11-26; просмотров: 1050;











