Координационный эффект титана
В силикатных стёклах титан находится в двух координациях: октаэдрической и тетраэдрической.
Ti4+: [TiO4]; [TiO6].
[TiO4] - здесь титан – стеклообразователь: ≡Si4+−O−Ti4+≡
[TiO6] - в этом случае титан – модификатор, стекло кристаллизуется либо ликвирует, так как полиэдр TiO6 не совместим со структурой силикатного стекла.
Чем выше основность стекла, тем большая часть титана способна переходить из шестерной координации в четверную. В стёклах, богатых оксидами Ме2О и MeO, координационное число титана понижается с 6 до 4. Во всех щёлочно-силикатных стёклах структурное положение титана характеризуется четверной координацией, формируются группировки [TiO4]. Основанием для такого вывода являются, в частности, исследования спектров комбинационного рассеяния и инфракрасных спектров поглощения. Колебания атомов в звене химической связи Ti – O вызывает появление полосы поглощения на ИК- спектре в области волновых чисел 740-780 см-1. Эта полоса характерна для группировок [TiO4] в кристаллах.
С другой стороны, оксид титана TiO2 широко применяется как «глушитель» в производстве белых эмалей и матовых стёкол (используют и другие термины для TiO2 – «минерализатор», «кристаллизатор»). При обжиге эмалей TiО2 выкристаллизовывается в форме рутила или анатаза, в которых титан находится в октаэдрической координации. Лёгкость выделения рутила из цинковых и магниевых эмалей указывает, что природа TiО2 не претерпевает существенных изменений, т.е. ион Ti4+ и в расплаве стекла и в кристаллах TiО2 остаётся в шестерной координации, выступая в качестве центрального катиона кислородного октаэдра [TiO6].
Фритты титановых эмалей получаются прозрачными. Выделение анатаза или рутила даёт сверхнепрозрачную белую эмаль. Глушение обусловлено выделением мелких кристаллов диоксида титана TiO2.
TiО2 (раствор) → анатаз или рутил
Отрицательное действие на выделение оксидов титана оказывают щелочные оксиды, в особенности оксид калия. Щелочные оксиды повышают растворимость TiO2 и препятствуют кристаллизации. Оксиды алюминия Al2O3, бора В2О3 и фосфора Р2О5 понижают растворимость оксидов титана.
Глушение возникает при диффузном рассеивании света от рассеивающих центров. Интенсивность глушения определяется разницей коэффициентов преломления стекломатрицы и кристаллов. Показатель преломления силикатного стекла в среднем равен n = 1,52. Поэтому коэффициент преломления глушителя должен быть менее 1,4 или более 1,8. Меньшие значения показателей преломления имеют, например, кристаллы фторида калия CaF2 (n = 1,43), криолита Na3AlF6 (n = 1,36), фторида натрия NaF (n = 1,33), относительно высокие значения показателя у кристаллов диоксида олова SnO2 (n = 2,04), оксида сурьмы Sb2O5 (n = 2,1).
Анатаз обычно выделяется в виде изомерных кубических кристаллов, иногда в виде игольчатых. Плотность анатаза ρ = 3,6 – 3,95 г/см3, а показатель преломления n = 2,55. Рутил выпадает в форме игольчатых кристаллов, его плотность ρ = 4,2 – 4,3 г/см3, показатель преломления n = 2,7. Для сравнения – показатель преломления алмаза n = 2,419; у оптического стекла марки тяжёлый флинт n = 1,778. Хорошо образованные прозрачные кристаллы рутила имеют показатель преломления больше, чем у алмаза, и могут служить ювелирными украшениями.
Анатаз обеспечивает лучшее глушение, чем рутил, так как выделяется, как правило, в виде изомерных бесцветных кристалликов, рассеяние света от которых придаёт эмали голубые тона. Рутил – выделяется в виде желтоватых или красноватых игольчатых кристалликов, придающих эмали кремовую белизну. Рутил легко воспринимает в решётку различные окрашивающие загрязнения, прежде всего оксиды хрома. Анатаз таких соединений не образует. Поэтому стремятся к выделению анатаза с голубоватой белизной, а не рутила с кремовой белизной.
Первичной кристаллической фазой диоксида титана, выделяющейся при обжиге эмали, является анатаз. Кристаллизации анатаза способствует высокое содержание TiО2 (15-20%) и низкая температура обжига (эмаль должна быть легкоплавкой). При повышении температуры анатаз необратимо переходит в рутил. Наиболее вероятные температуры этого превращения 800-850оС. Температура плавления рутила - 1870оС, температура разложения - 2900оС. Низкая температура обжига эмали, способствующая выделению анатаза, достигается за счёт высокого содержания оксида бора В2О3 (15-20 мас. %), а не щелочных оксидов.
В температурной области равновесного перехода «анатаз ↔ рутил» введение Р2О5, ZnO, 1-2% MgO вызывает появление преимущественно анатаза, он стабилизируется ионами S6+, As5+, P5+, Se4+. Выделившийся анатаз в присутствии щелочных оксидов (особенно К2О, в меньшей степени Na2O и Li2O) ускоренно переходит в рутил. Переход анатаза в рутил не является полиморфным превращением. Кристаллы диоксида титана в виде анатаза переходят в раствор и выделяются в виде рутила на уже имеющихся кристаллах рутила, вследствие чего они растут.
Оптимальный размер кристаллов достигается при определённом содержании диоксида титана и определённой температуре обжига. Наиболее белые эмали получаются при размере кристалликов диоксида титана 150-250 нм. При меньших размерах эмаль приобретает синий оттенок, при больших – жёлтый.
Координация катионов титана влияет на свойства стёкол. Исследовали микротвёрдость силикатных стёкол системы
16 Na2O·20MeO·10TiO2·54SiO2 ,
где MeO: BeO→MgO→CaO→SrO→BaO.
В этом ряду:
1) увеличивается радиус катиона Ме2+, что приводит к разрыхлению структуры стекла;
2) понижается среднее координационное число Тi4+ .
Оба названных фактора ведут к понижению микротвёрдости стекла.
Изучили систему 16Na2O·20MeO·10Al2O3·54SiО2 . В этих алюмосиликатных стёклах действует только первый фактор из упомянутых выше, поскольку отношение Na2O/Al2O3 >1 и алюминий всегда находится в тетраэдрической координации. Поэтому микротвёрдость соответствующих алюмосиликатных стёкол уменьшается слабее.
2.3. Поляризационные явления в стёклах
Поляризация ионов
Электронные оболочки молекул или ионов под действием электрического поля деформируются. Поляризация диэлектриков, обусловленная наведёнными или индуцированными диполями, связана со смещением электронов относительно ядер во внешнем электрическом поле.
Молярная поляризация, обусловленная только наведенными дипольными или индуцированными диполями, называется молярной рефракцией.
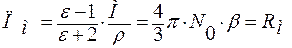 .
.
Для сложного вещества поляризация рассчитывается по формуле:
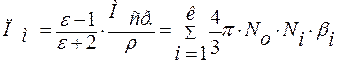 ,
,
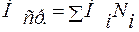 ;
;
ε – диэлектрическая проницаемость;
М – молекулярная масса;
Ni – мольная доля;
ρ – плотность вещества;
b – электронная поляризуемость, характеризует легкость смещения электронов относительно ядер во внешнем электрическом поле.
Молярная поляризация имеет размерность объёма (см3), она характеризует смещение электронного облака. Это смещение по порядку величины равно размеру атома.
Диэлектрическую постоянную используют для описания поведения молекулы в постоянном электрическом поле. Диэлектрическая проницаемость ε показывает ослабление силы взаимодействия двух зарядов в данной среде по сравнению с вакуумом.
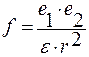 ,
,
r – расстояние между зарядами;
ε = 1 — для вакуума;
ε = 103-104 – для специальных керамик, содержащих оксиды титана TiO2 и бора В2О3.
В поле световой волны поведение вещества можно характеризовать показателем преломления света. При достаточно больших длинах волн, в областях, удалённых от области аномальной дисперсии (рис. 2.16), диэлектрическая проницаемость рассчитывается по формуле: ε = n2. Аномальная дисперсия связана с резонансным поглощением электромагнитных волн веществом.
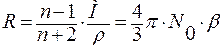 .
.
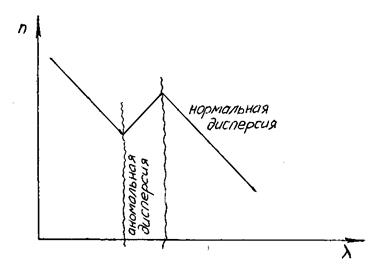
Рис. 2.16. Изменение показателя преломления с длиной волны электромагнитного излучения
По размеру величины рефракция обычно составляет десятые доли от объёма иона или атома. Для ионных кристаллов не удается непосредственно измерить диэлектрическую постоянную. Зато такие вещества, как правило, прозрачны и для них можно найти показатель преломления n. По значениям n легко определить молярную рефракцию вещества.
Поляризация (деформация) иона кислорода центральным (каркасным) катионом упрочняет связь внутри кислородного полиэдра. Расстояние между центральным катионом и анионами уменьшается. Поляризация того же иона кислорода внерадикальным катионом ослабляет связь иона кислорода с центральным катионом.
За редким исключением поляризуемость анионов намного выше, чем катионов. При одинаковом строении электронной оболочки с увеличением заряда ядра рефракция атомов или ионов убывает (табл. 2.9).
Таблица 2.9
Влияние заряда ядра на поляризацию частиц
| Ион или атом | Строение электронной оболочки | Заряд ядра | R~β, см3/г∙ион |
| О2- | 1s22s22p6 | 7,0 | |
| F- | 1s22s22p6 | 2,5 | |
| Ne | 1s22s22p6 | 1,0 | |
| Na+ | 1s22s22p6 | 0,5 | |
| Mg2+ | 1s22s22p6 | 0,2 |
Ионы, имеющие большую рефракцию, легко поляризуются. Значения рефракции анионов и катионов сведены в таблицы.
Во многих твёрдых телах рефракция складывается аддитивно из рефракции катионов и рефракции анионов.
Rм ≈ RК+ + RА-
Отдельно рефракции ионов можно найти
RHCl ≈ RH+ + RCl- = RCl-
Рефракция катиона водорода равна нулю, т.к. это ядро и нет смысла говорить о смещении электрона.
RNaCl ≈ RNa+ + RCl-
Рефракцию NaCl измеряем, рефракцию аниона хлора знаем, находим рефракцию катиона натрия.
RNaF ≈ RNa+ + RF-
По аналогии находим рефракцию аниона хлора. Таким путём нашли рефракции различных веществ.
Рефракцию маленьких катионов в различных соединениях можно считать постоянной. Рефракции крупных катионов и всех анионов изменчивы. Рефракция кислорода в соединениях тем меньше, чем он сильнее поляризован, т.е. чем больше ковалентность химической связи Ме–О (табл. 2.10).
Таблица 2.10
Поляризация кислорода в различных веществах
| Вещество | Кислород кристаллический | Al2O3 | SiO2 | В2О3 | СО2 |
| RO2-, см3/г-ион | 6,28 | 4,34 | 3,64 | 3,45 | 3,3 |
В отсутствие легко поляризующихся катионов рефракцию кислорода в стёклах вычисляют по разности, пользуясь формулой аддитивности.
Стекло: xNa2O∙yCaO∙zSiO2.
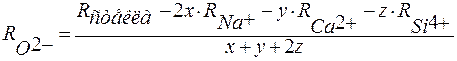 .
.
Рефракция иона кислорода отражает среднюю степень ионности-ковалентности химических связей в стёклах. По величине рефракции отдельных оксидов в стекле можно судить о координационном состоянии соответствующих катионов.
Дата добавления: 2018-11-26; просмотров: 904;











