Электролиз. Законы Фарадея
Общие понятия об электрохимических системах
Электрохимия – это раздел физической химии, в котором изучаются законы взаимного превращения химической и электрической формы энергии и систем, где эти превращения совершаются. Электрические системы и явления рассматриваются в равновесных условиях в отсутствии электрического тока и в неравновесных при прохождении электрического тока.
В разделе электрохимии изучаются физико-химические свойства ионных проводников, процессы и явления на границе раздела фаз с участием заряженных частиц – ионов и электронов.
Электрохимия, как наука, возникла на рубеже 18-19 веков на основании трудов Л. Гальвани, А. Вольта, В. Петрова, Г. Деви и М. Фарадея.
Электрохимия имеет большое практическое значение, а именно: электролиз в металлургии легких и цветных металлов, химическая промышленность, технология гальванотехники, коррозия и защита металлов.
Проводники электрических зарядов
Проводники электрического тока делятся на электронные, или проводники I рода, и ионные – проводники II рода.
Проводники I рода: передача электричества осуществляется движением электронов электронного газа. К ним относятся металлы в твердом и расправленных состояниях.
К проводникам II рода принадлежат растворы солей, кислот и оснований, и соли в расплавленном состоянии. Передача электричества осуществляется в них движением положительных и отрицательных ионов.
Существуют вещества, обладающие смешанной проводимостью.
Электролиз. Законы Фарадея
Взаимное превращение электрической м химической энергии происходит в электрохимических системах, состоящих из следующих частей:
1. Проводники II рода;
2. Проводники I рода – металлические электроды. Положительный электрод называется анодом, отрицательный – катодом.
3. Проводники I рода – внешняя электрическая цепь, связывающая электроды.
Электролиз – это химическое превращение в электрической системе под действием внешнего электрического поля.
При электролизе отрицательные ионы движутся к аноду (+) – анионы. Положительно заряженные частицы – катионы – двигаются к катоду.
Вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов называются электролитами.
Представим систему, в которой имеется раствор медного купороса (CuSO4 + H2O). При растворении в воде электролита происходит диссоциация на ионы
CuSO4 ⇆ Сu2+ + SO42-
При погружении в раствор электродов (катода и анода) начинается направленное движение ионов.
На катоде происходит восстановление меди по реакции:
Cu2+ + 2e → Cu0
и выделяется на нем металлическая медь.
Соотношение между (количеством) массой прореагировавших веществ и количеством постоянного электрического выражается законами Фарадея.
Первый закон Фарадея: Масса вещества m претерпевшего химическое превращение под действием электрического тока пропорциональна количеству протекшего электрического тока.
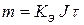 , где
, где 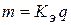 (1.1)
(1.1)
где:
m – масса вещества;
J – сила тока;
τ – время электролиза
Kэ – электрохимический эквивалент.
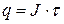 – количество электричества.
– количество электричества.
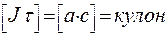
Второй закон Фарадея: При прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в реакциях, пропорциональны их химическим эквивалентам.
Для выделения 1 г–экв. любого вещества требуется пропустить 1 Фарадей электричества.
1 Фарадей = 1F = 96500 Кл
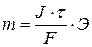 (1.2)
(1.2)
Э – химический эквивалент, 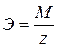 ;
;
M – мольная масса вещества;
z – число 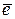 , принимающих участие в электродной реакции.
, принимающих участие в электродной реакции.
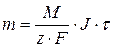 , (1.3)
, (1.3)
тогда 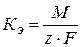 – электрохимический эквивалент
– электрохимический эквивалент
II закон Фарадея дает физический смысл Kэ: Кэ – это количество вещества, которое претерпевает превращение при пропускании через раствор 1 Кл электричества.
На практике часто наблюдается отклонение от законов Фарадея вследствие протекания побочных реакций; а именно:
1). в электролитах, содержащих кислоты, происходит дополнительно восстановление водорода (кислота увеличивает электропроводность)
Например: электролит ZnSO4 + H2SO4
на катоде(−):
Zn2+ + 2e → Zn0 – основная
2Н+ + 2е→H2 ↑– побочная
2). Неполное восстановление металла на катоде:
Fe3+ + 3e→ Fe0
Fe3+ + 1e→ Fe2+
3). Наличие нескольких реакций восстановления на катоде:
Au3+ + 3e→ Au0 – основная
Au1+ + 1e→ Au0 - побочная
4). Взаимодействие продуктов электролиза с электролитом:
H2O + NaCl
H2O ⇆ H+ + OH-
Ионы щелочных металлов не восстанавливаются, на катоде идет восстановление водорода:
(−) 2H2+ + 2e = H2↑
В прикатодном пространстве накапливаются ионы натрия, в прианодном - ионы гидроксила
На аноде идет окисление CI— ионов:
(+) 2CI− − 2e →CI2↑ выделяется газ.
Образующаяся NaOH взаимодействует с CI2:
2NaOH + CI2 = NaCI + NaCIO + H2O
Эффективность электрохимического процесса оценивается величиной выхода по току
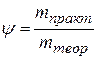 (1.4)
(1.4)
В отсутствии побочных процессов ψ =1, но на самом деле ψ < 1.
Дата добавления: 2018-05-10; просмотров: 1769;











