Классификация гальванических элементов
По источнику ЭДС гальванические элементы делятся на химические и концентрационные.
В химических ГЭ источником ЭДС является химическая реакция. В концентрационных ГЭ ЭДС возникает за счет разной концентрации ионов в растворах и вещества на электродах.
И химические и концентрационные ГЭ по наличию или отсутствию диффузионной разности потенциалов ( 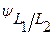 ) делятся на элементы с переносом и элементы без переноса.
) делятся на элементы с переносом и элементы без переноса.
Пример1.
Ag | AgClТВ |KCl || KCl | (Cl2) Pt
Ag – e + Cl- = AgClТВ
Cl2 + 2e = 2Cl-
2 Ag + Cl2+ 2Cl-(лев) = 2AgClтв + 2Cl-(прав)
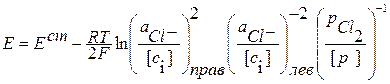
В элементе ЭДС возникает за счет химической реакции и ее величина зависит от активности компонентов, участвующих в ней. В элементе имеется граница раздела между двумя электролитами KCl. Следовательно данный элемент относится к химическим элементам с переносом.
Пример 2
Но если оба электрода поместить в один электролит, то получим элемент
Ag | AgClТВ |KCl | (Cl2) Pt
Ag – e + Cl- = AgClТВ
Cl2 + 2e = 2Cl-
2 Ag + Cl2 = 2AgClтв
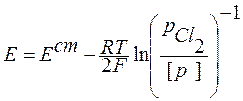
В этом элементе нет границы раздела между электролитами, это химический элемент без переноса.
Пример 3.
Zn | ZnSO4 || ZnSO4 | Zn
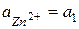
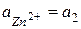
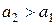
Zn – 2e = Zn2+ 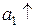
Zn2+ +2e = Zn 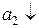
(Zn2+)пр + Zn = (Zn2+)лев + Zn
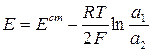
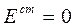
В общем случае
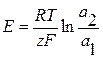
Элемент состоит из одинаковых электродов, различаются только концентрации ионов Zn2+ в растворах - это концентрационный элемент с переносом.
Пример 4
Pt (H2) | HCl (водный раствор) | (H2) Pt
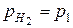
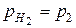
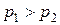
H2 - 2 e + 2H2O = 2H3O+ 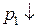
2H3O+ + 2e = H2 +2H2O 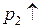
(H2)лев = (H2)прав
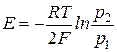 или
или 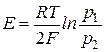
Это концентрационный элемент без переноса.
Дата добавления: 2018-05-10; просмотров: 3270;











