Закон разведения Оствальда
Процесс распада растворенного вещества в растворе на ионы называется электролитической диссоциацией.
Первая количественная теория растворов электролитов (теория электролитической диссоциации) была высказана Аррениусом. По этой теории молекулы кислот, оснований и солей при растворении распадаются на противоположно заряженные ионы. Процесс диссоциации электролитов обратим, происходит образование молекулы из ионов, т.е. в растворе существуют ионы и молекулы. Равновесие между ионами и молекулами подчиняется закону действующих масс.
Для электролита AB, диссоциирующего в растворе на ионы по схеме
AB ⇆ A+ + B−
выражение для константы диссоциации имеет вид
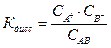 (1.5)
(1.5)
В состоянии равновесия доля молекул, распавшихся на ионы, характеризует степень диссоциации электролита 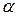 , которая зависит от:
, которая зависит от:
1. природы растворителя;
2. концентрации электролита;
3. температуры;
4. присутствия других растворителей.
С учетом степени диссоциации равновесные концентрации частиц будут равны
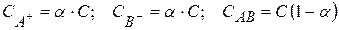
Тогда
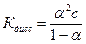 (1.6)
(1.6)
− это уравнение называется законом разведения Оствальда и описывает поведение слабых электролитов.
При малых значениях 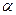 можно принять, что
можно принять, что 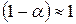 , тогда
, тогда
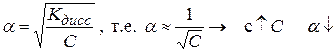 (1.7)
(1.7)
Kдисс = f (T, природы растворителя), но не зависит от концентрации электролита в растворе.
Свойства растворов электролитов существенно отличаются от свойств идеальных растворов. Это объясняется увеличением числа частиц в растворе электролита за счет диссоциации и электролитическим взаимодействием между ними.
Вант-Гофф обнаружил увеличение осмотического давления в растворах электролитов
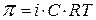 (1.8)
(1.8)
где 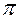 – осмотическое давление
– осмотическое давление
i– изотонический коэффициент Вант – Гоффа (i >1)
c– концентрация в моль/л
В водных растворах NaCI i ≈2, в BaCI2 ~3 – он (i) показывает приближенно число ионов, на которые диссоциируют молекулы электролита.
Для слабых электролитов, при диссоциации которых образуется νионов
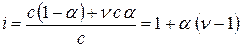 (1.9)
(1.9)
i связан со степенью диссоциации 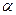 .
.
Отклонение свойств реальных растворов от свойств идеальных растворов учитывается с помощью коэффициентов активности, а концентрацию слабых электролитов заменяют на активность
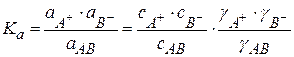 (1.10)
(1.10)
Ka – термодинамическая константа диссоциации.
Ионы в растворах электролитов сольватированы молекулами растворителя, поэтому при написании выражений для константы диссоциации необходимо учитывать и молекулы растворителя.
Например: HA – слабый электролит, органическая кислота в водном растворе, тогда диссоциация идет по уравнению
HA + H2O ⇆ H₃O⁺ +A–
H3O+ – ион гидроксония
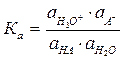 (1.11)
(1.11)
Процесс ионизации (или диссоциации) одноосновной кислоты правильно будет представить совокупностью двух уравнений
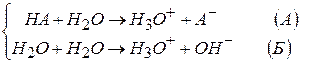
Вклад реакции (Б) в общее изменение концентрации H3O+ невелик, им можно пренебречь.
Тогда
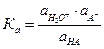 или для идеальных разбавленных растворов
или для идеальных разбавленных растворов
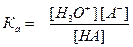 , где [H3O⁺], [A-], [HA] - равновесные концентрации.
, где [H3O⁺], [A-], [HA] - равновесные концентрации.
Значение Ka при 298 K это справочная величина.
Сложнее обстоит дело с диссоциацией двухосновных кислот (H2S, H2CO3, H2SO3 и т.д.)
Обозначим их общей формулой H2A
При установлении протолитического равновесия справедливы следующие реакции:
H2A + H2O → H3O+ + HA– (A)
HA– + H2O → H3O+ + A2- (Б)
H2O + H2O → H3O+ + OH– (B)
Вклад реакции (В) в общее изменение концентрации невелик.
При ионизации кислот по первой ступени
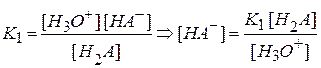 ,
,
а по второй ступени
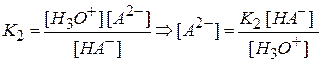
Таким образом, в растворе в равновесном состоянии одновременно могут находиться недиссоциированная кислота H2A и ионы: HA– и A2-.
Уравнение материального баланса по аниону имеет следующий вид:
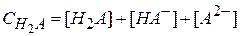 .
.
Дата добавления: 2018-05-10; просмотров: 3409;











