Влияние природы растворителя на предельную подвижность ионов
Толь в водных растворах и спиртах сохраняется высокая подвижность ионов H+ (протонов), а OH- в воде.
При взаимодействии HCI со спиртом образуется катион этоксоний (общее название меоксоний):


 HCI + C2H5OH = C2H5OH2+ +CI-
HCI + C2H5OH = C2H5OH2+ +CI-
Этоксоний
HCI + H2O = H3O+ + CI-
гидроксоний
Эстафетный механизм передачи протона вдоль цепочки молекул растворителя сохраняется и в спиртах.
Подвижность ионов в различных растворителях зависит от диэлектрической проницаемости растворителя. Чем выше диэлектрическая проницаемость (ε) растворителя, тем выше степень диссоциации электролита и электрическая проводимость раствора.
Зависимость молярной электропроводности ионов
от вида растворителя.
| ион | 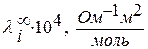
| ||||
| H2O | CH3OH | C2H5OH | (CH)2CO | C6H5-NO2-нитробензол | |
| Н+ | 349,8 | 159,5 | |||
| Na+ | 56,1 | 45,2 | 17,2 | ||
| K+ | 73,5 | 52,4 | 19,2 | ||
| CI- | 76,1 | 52,9 | 24,3 | 17,1 | |
| OH- | 197,6 | 22,5 |
Зависимость молярная электрическая проводимость HCI
от диэлектрической проводимости растворителя (t=250C, p=1атм.)
| Растворитель | 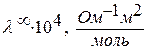
| Диэлектрическая проницаемость растворителя (ε) |
| Н2О | ||
| CH3OH | 31,2 | |
| C2H5OH | 27,2 | 25,8 |
| (C2H5)2О | 0,044 | 4,37 |
Дата добавления: 2018-05-10; просмотров: 1375;











