Гальванического элемента
Изменение энергии Гиббса в ходе химического процесса:
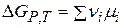
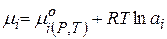 (чаще всего концентрация в С - шкале).
(чаще всего концентрация в С - шкале).
Для газовых электродов:
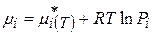
Тогда 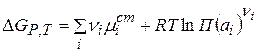
Изменение энергии Гиббса в ходе электрохимической реакции
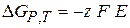
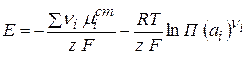 (2.9)
(2.9)
Это постоянная величина при заданных давлении и температуре, она называется стандартная ЭДС гальванического элемента – Е0 и определяется только природой реакции.
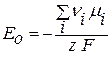 (2.10)
(2.10)
Исходя из изотермы химической реакции, можно записать выражение для Е0:
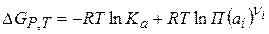
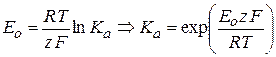 (2.11)
(2.11)
Исходя из этого, можно записать уравнение Нернста для определения ЭДС гальванического элемента:
 (2.12)
(2.12)
R, T, F не зависят от природы реакции, вводится сonst:
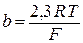 (2.13)
(2.13)
При Т=298 К (250С) 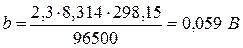
При 293 К 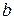 =0,058
=0,058
Выражение для расчета ЭДС примет вид:
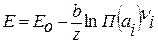 (2.14)
(2.14)
Для гальванического элемента Даниэля-Якоби:
Zn – 2e = Zn2+ (Окисление)
Cu2+ + 2e = Cu0 (восстановление)
Zn + Cu2+ = Cu0 + Zn2+
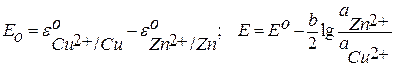
Классификация электродов
Электрод - это часть гальванического элемента, сочетание проводника 1 рода (металла) и проводника 2 рода(электролита). Электроды классифицируются по виду компонентов, участвующих в электродной реакции.
Дата добавления: 2018-05-10; просмотров: 1038;











