Влияние концентрации реагирующих веществ на скорость реакции
Зависимость скорости реакции от концентрации реагирующих веществ описывается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Закон был сформулирован в 1867 году норвежскими учеными Гульбергом и Вааге.
Если реакция описывается уравнением mA + nB = pC, то математическое выражение закона для данной реакции:
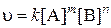 , ,
| (6.3) |
где [A], [B] – молярные концентрации веществ; m, n – стехиометрические коэффициенты, называемые порядками реакции по веществам А и В.
Порядки совпадают со значениями коэффициентов для самых простых реакций. Вероятность одновременного столкновения более чем трех частиц крайне мала, поэтому сложные реакции, уравнения которых содержат большое число частиц, представляют собой совокупность последовательно или параллельно протекающих стадий, которые происходят при столкновении двух частиц (бимолекулярные реакции), распада одной частицы (мономолекулярные реакции). Истинные порядки реакций могут изменяться от 0 до величины коэффициента и принимать дробные значения, что устанавливается экспериментально при изучении механизма реакции.
Коэффициент k в кинетическом уравнении химической реакции – константа скорости химической реакции, которая равна скорости реакции, когда произведение концентраций реагирующих веществ равно 1. Она зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ.
Для реакции 2Н2 + О2 = 2Н2О выражение закона действия масс будет иметь вид: υ = k[Н2]2[O2].
В гетерогенных системах (например: газ – твердое тело) столкновение реагирующих молекул происходит на поверхности раздела фаз. При этом поверхность твердого вещества представляет собой величину постоянную и входит в выражение константы скорости. Поэтому для гетерогенной реакции между оксидом железа (II) и водородом:
FeO(к) + H2(г) = Fe(к) + H2O(г),
выражение закона действующих масс примет вид:
υ = k[H2].
Чем больше поверхность раздела фаз, на которой происходит реакция тем выше скорость реакции. Твердые вещества реагируют тем быстрее, чем сильнее они измельчены. С другой стороны скорость реакции зависит от скорости подвода к твердой поверхности газообразного или растворенного вещества. Восполнить убыль реагента у поверхности твердого вещества можно перемешиванием.
Дата добавления: 2017-11-21; просмотров: 2206;











