Металлическая связь
Атомы большинства металлов на внешнем энергетическом уровне содержат один, два и реже три электрона. Из-за низкой энергии ионизации электроны в металле могут, отрываясь от атома переходить в межатомное пространство, становясь общими.
Межмолекулярное взаимодействие
Ван-дер-Ваальсовы силы
Межмолекулярное взаимодействие обусловлено Ван-дер-Ваальсовыми силами (электростатическими). Оно является значительно более слабым, чем химическая связь. Полярные молекулы (диполи) взаимодействуют противоположными полюсами, образуя ассоциаты. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи. Флуктуации электрической плотности в молекулах, ведут к появлению мгновенных диполей, которые, в свою очередь, индуцируют мгновенные диполи у соседних молекул. В результате взаимодействия мгновенных диполей энергия системы понижается.
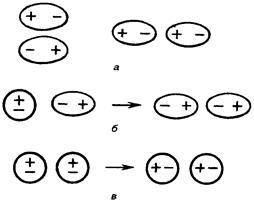
Рис. 4.14. Ван-дер-Ваальсовы взаимодействия молекул: а – диполь-дипольное (ориентационное); б – дисперсионное; в – индукционное взаимодействие
Сжижение газов происходит благодаря возрастанию сил межмолекулярного взаимодействия при повышении давления и понижении температуры.
Водородная связь
Водородная связь возникает между молекулами, имеющими в своем составе атомы водорода и атом сильно электроотрицательного элемента (например, азота, кислорода, фтора). Образование водородной связи обусловлено тем, что в полярных молекулах или полярных группах поляризованный атом водорода имеет очень малый размер, у него отсутствуют внутренние электронные оболочеки, электронная пара связи сдвинута к более электроотрицательному атому. Поэтому водород способен внедряться в электронную оболочку отрицательно поляризованного атома соседней молекулы.
Водородные связи могут возникать как между одинаковыми молекулами F-H ××× F-H , так и разными, как при взаимодействии воды и фтороводорода: Н2О…НF.
Энергия водородной связи возрастает с увеличением ЭО и уменьшением радиуса атомов неметалла. Энергия связи (кДж/моль) приведена в ряду:
–H ××× F − (25 - 42); –Н ××× О< (13-19); –Н ××× N ≡ (8-21) .
Несмотря на высокую ЭО, у хлора водородная связь –H×××Cl– относительно слабая из-за большого размера атома хлора.
Как видно, энергия водородной связи ниже энергии ковалентной связи, а длина больше. Так, у воды длина связи О–Н - 0,096 нм, а связи О×××Н - 0,177 нм.
При возникновении водородных связей образуются димеры, тримеры или полимерные структуры. Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температуры кипения и плавления, теплоты плавления и парообразования.
Водородная связь может также возникнуть между атомами водорода и отрицательными атомами полярных групп в одной и той же молекуле. Например в белках, у которых спиральные полимерные структуры объединяются связями =N-H ××× О<. Спирали нуклеиновых кислот также соединяются между собой водородными связями.
Дата добавления: 2017-11-21; просмотров: 1301;











