Химическое равновесие
Все химические реакции подразделяются на необратимые и обратимые, которых большинство. Обратимые реакции протекают одновременно в двух противоположных направлениях.
Для обратимого химического процесса между веществами А и В можно записать выражение скоростей прямой и обратной реакций. В состоянии равновесия они равны:
mA + nB D pC + qD
υ1 = k1[A]m[B]n; υ2 = k2[C]p[D]q
k1[A]m[B]n = k2[C]p[D]q
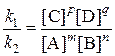 .
.
Найдя отношение констант скоростей прямой и обратной реакций, заменим их постоянной величиной K, называемой константой химического равновесия. Константа химического равновесия определяется природой реагирующих веществ и температурой, но не зависит от концентрации.
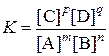 . .
| (6.6) |
Состояние же химического равновесия зависит от концентрации реагирующих веществ, температуры и если в реакции участвуют газы, то и давления. Изменение одного из указанных параметров вызывает смещение равновесия, при этом изменяются концентрации всех реагирующих веществ. Изменение концентраций продолжается до равенства скоростей прямой и обратной реакций. Тогда равновесие установится уже при других концентрациях веществ.
Принцип Ле-Шателье
Направление, в котором смещается равновесие, определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.
Для примера можно рассмотреть реакцию синтеза аммиака. Прямая реакция является экзотермической и идет с уменьшением объема.
N2 + 3H2 D 2NH3 –DН.
Если увеличить концентрацию азота, то ускоряется та реакция, в которой данное вещество расходуется (концентрация азота ↑→).
Если повысить температуру системы, то ускоряется эндотермическая (обратная) реакция (ΔH > 0), (t°↑←), при понижении температуры равновесие смещается в сторону экзотермического процесса (ΔH < 0); (t°↓→).
Поскольку в реакции участвуют газы, то повышение давления ускоряет ту реакцию, которая ведет к уменьшению числа молей газообразных веществ, т.е. уменьшению объема газов и общего давления (р↑→).
Катализаторы не смещают равновесия реакции. Катализаторы могут ускорять наступление химического равновесия, но не влияют на константу равновесия. Катализатор одновременно увеличивает скорости прямой и обратной химических реакций.
Таким образом, для увеличения выхода аммиака можно:
- увеличить концентрацию азота и водорода и уменьшить концентрацию аммиака;
- уменьшить температуру;
- увеличить давление;
- использовать катализатор (для увеличения скорости достижения состояния равновесия).
Фазовые равновесия
Равновесие процесса перехода вещества из одного агрегатного состояния в другое или из одной модификации в другую без изменения химического состава называется фазовым равновесием.
Фаза – гомогенная часть системы, имеющая одинаковый состав и свойства, отграниченная от других гомогенных частей системы поверхностью раздела.
Примеры фазового равновесия: плавление и кристаллизация металла (равновесие твердое вещество/жидкость), испарение и конденсация жидкости (равновесие жидкость/пар), переход одной модификации вещества в другую (Sромбическая D Sмоноклинная). Фазовое равновесие – динамическое равновесие, т.е. скорость прямого и обратного процессов равны. Условием равновесия является DG = 0. Для фазового равновесия соблюдается принцип Ле-Шателье. Т.е. при повышении температуры равновесие сдвигается в сторону эндотермического процесса (плавление, испарение), при повышении давления – в сторону уменьшения объема системы (конденсация, сублимация).
Компонент – составная часть системы, однородное вещество, может быть выделено из системы, и существовать в изолированном виде в течение длительного времени. Например, в водном растворе хлорида натрия H2O и NaCl представляют собой компоненты системы.
Если система содержит взаимодействующие вещества, то среди них есть независимые компоненты, число которых достаточно для образования всех фаз системы. Их число меньше общего числа компонентов на число протекающих между ними реакций. В системе, состоящей из аммиака, хлороводорода и хлорида аммония, имеет место реакция: HCl + NH3 = NH4Cl. В системе два независимых компонента (HCl и NH3), т.к. количество третьего определяется равновесием при известных количествах двух других. По числу компонентов различают одно-, двух-, трехкомпонентные системы.
Зависимость состояния системы и фазовых равновесий в ней от внешних условий или ее состава выражается диаграммой состояния или фазовой диаграммой.
Рассмотрим однокомпонентную систему на примере воды (диаграмма состояния воды рис. 6.3).
На диаграмме области, находящиеся между кривыми, являются однофазными. В этих областях можно менять температуру и давление, не изменяя числа фаз.
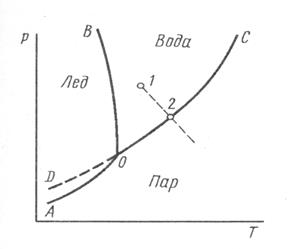
Рис.6.3. Диаграмма состояния воды.
Кривые соответствуют условиям равновесия между фазами: ОС – кипение, ОВ – плавления, ОА – сублимации (переход из твердого состояния в газ, минуя жидкое), ОD – метастабильное состояние переохлаждения жидкой воды.
В точке О все три фазы находятся в равновесии – тройная точка (273,16 К, 6,11 гПа). При изменении значений давления или температуры в системе остается только 2 фазы. Т.е. нельзя изменить ни одно из условий, не изменив числа фаз (система в точке О – инвариантная система).
Равновесие между жидкой водой и паром возможно при различных давлениях и температурах, но при этом каждому значению р соответствует определенное Т. Если изменять один фактор не меняя второго, остается одна фаза. (Повышение Т при р = const ведет к испарению.)
Число условий (Т р, с), которые можно менять произвольно в некоторых пределах без изменения числа фаз – число степеней свободы. Число степеней свободы (С) характеризует вариантность системы. Так в точке О С = 0 – инвариантная система. С = 1 – моновариантная система, С = 2 – дивариантная система.
Правило фаз: в равновесной системе число фаз (Ф), число степеней свободы (С) и число независимых компонентов (К) связаны соотношением:
С + Ф = К +2, или С = К – Ф +2 (6.7)
Правило сформулировано американским физиком Дж.У.Гиббсом в 1873-1876 гг.
Для однокомпонентной системы (К = 1):
1) при Ф = 1 и С = 2 (С = 1 – 1 + 2 = 2) – дивариантная система;
2) при Ф = 2 (С = 1 + 2 – 2 = 1) –моновариантная;
3) при Ф = 3 – инвариантная система.
Более 3-х фаз в системе существовать не может.
Изучение многокомпонентных систем, образующих несколько фаз, производится при помощи физико-химического анализа, частным случаем которого является термический анализ.
Термический анализ
Для определения равновесия между кристаллическим веществом и жидкой фазой используют метод термического анализа. В основе этого метода лежит исследование скорости изменения температуры системы по мере ее охлаждения из расплава (рис. 6.4). Пока вещество охлаждается, находясь в жидком состоянии, температура понижается равномерно. Когда начинается кристаллизация вещества, протекающая с выделением тепла, падение температуры прекращается, на кривой появляется излом. При кристаллизации чистого вещества это – горизонтальный участок (А, В). При кристаллизации компонента двухкомпонентной системы в точке начала кристаллизации наблюдается перелом кривой, поскольку при выпадении кристаллов одного вещества увеличивается концентрация второго и температура кристаллизации первого понижается. Поэтому этот участок имеет некоторый наклон вплоть до момента совместного выпадения кристаллов смеси. После чего система линейно понижает свою температуру до температуры окружающей среды. Кривые зависимости температуры от времени – кривые охлаждения.
На основании кривых охлаждения чистых веществ и их смесей производят построение диаграмм плавкости смеси компонентов. Такие диаграммы строят для характеристики сплавов металлов. Сплавы металлов – основной конструкционный материал в современном машиностроении. Они обладают более высокой прочностью и твердостью, более низкими температурами плавления, чем чистые металлы.
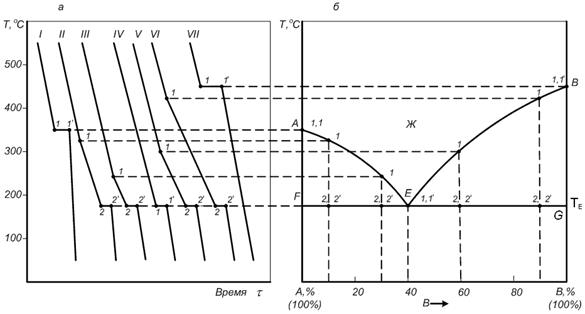
Рис.6.4.Построение по кривым охлаждения (а) диаграммы плавкости (б) двухкомпонентной системы.
На рис. 6.3 представлена схема построения диаграммы состояния двухкомпонентной системы по кривым охлаждения расплава. По изломам на кривых охлаждения чистых веществ А и В определяют температуры плавления этих компонентов. По кривым охлаждения смесей компонентов определяют температуры кристаллизации компонентов при различном их процентном содержании в составе смеси. Каждая точка на кривой АЕ соответствует составу расплава, находящемуся в равновесии с кристаллами компонента А при данной температуре. Кривая ВЕ указывает состав расплава, который при соответствующей температуре находится в равновесии с кристаллами В. Кривая АЕВ – линия ликвидуса, выше которой система находится в жидкой фазе.
Точка Е пересечения кривых АЕ и ВЕ показывает температуру и состав расплава, который одновременно находится в равновесии с кристаллами обоих компонентов – точка эвтектики. В этой точке при эвтектической температуре из эвтектического расплава происходит выпадение кристаллов твердой эвтектики, состоящей из двух твердых фаз компонентов. Горизонтальная прямая, проходящая через точку Е – линия солидуса, ниже которой жидкая фаза отсутствует.
Контрольные вопросы
1. Дайте определение скорости химической реакции.
2. Дайте формулировку закона действия масс для гомогенной и гетерогенной реакции.
3. Дайте определение константы скорости химической реакции. От каких параметров она зависит?
4. Охарактеризуйте влияние температуры на скорость химической реакции (правило Вант-Гоффа).
5. Прокомментируйте уравнение Аррениуса. Дайте определение энергии активации.
6. Что такое катализатор? Каков механизм действия катализатора? Приведите примеры гомогенного и гетерогенного катализа.
7. Дайте определения обратимой химической реакции и химического равновесия.
8. Дайте вывод константы химического равновесия, от каких параметров она зависит?
9. Дайте формулировку принципа Ле-Шателье. Приведите пример обратимой химической реакции, объясните, как интенсивность различных параметров может влиять на смещение равновесия реакции.
10. Что такое фазовые равновесия? Дайте определения понятиям: фаза, компонент, независимый компонент, степень свободы.
11. Сформулируйте правило фаз. Рассмотрите моно-, ди-, и инвариантные системы на примере диаграммы состояния воды. Пользуясь уравнением Клапейрона-Клаузиуса, на примере этой диаграммы рассмотрите зависимость температуры фазового перехода от давления.
12. Что такое термический анализ, для чего он применяется? Как по кривым охлаждения строят диаграммы состояния?
Примеры решения задач
Пример 1. Как изменится скорость химической реакции: СО + О2 ® СО2, если концентрацию угарного газа повысить в 3 раза?
| Дано: | Решение: |
| [CO]2 = 3[CO]1 | 1.Составим уравнение реакции: |
| Найти: n2/n1 | 2СО + О2 = 2 СО2 |
2. Напишем выражение закона действия масс для этого процесса при исходных условиях:
n1 = k[CO]2×[O2]
3.Напишем выражение закона действия масс для этого процесса с учетом повышения концентрации СО в 3 раза. (Константа скорости реакции (k) не зависит от концентрации реагентов).
n2 = k (3[CO])2×[O2]
4.Составим отношение 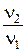 :
:
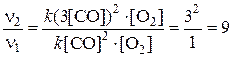
Ответ: при возрастании концентрации СО в 3 раза скорость химической реакции увеличится в 9 раз.
Пример 2. Как изменится скорость химической реакции при снижении температуры процесса с 1030°С до 1000°С, если температурный коэффициент реакции равен 2?
| Дано: | Решение: |
| t1 = 1030°C | 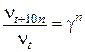
|
| t2 = 1000°C | 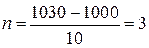
|
| g = 2 | По условию задачи t1 > t2, следовательно v1 > v2 |
| Найти: n1/n2 | n1/n2= gn, gn = 23 = 8 |
Ответ: скорость химической реакции уменьшится в 8 раз.
Пример 3. В направлении какого процесса сместится равновесие системы SO2 + O2 ® SO3; DН < 0 при а) возрастании концентрации SO2; б) снижении температуры; в) повышении давления; г) внесении катализатора? Составьте выражение константы химического равновесия для этой системы.
Решение:
1)Составим термохимическое уравнение:
2SO2(г) + O2(г) D 2SO3(г) + Q (ΔН < 0, реакция экзотермическая)
В соответствии с принципом Ле-Шателье:
а) равновесие смещается вправо, в сторону прямой реакции, понижающей концентрацию SO2;
б) равновесие смещается в сторону экзотермической реакции, т.е. вправо;
в) равновесие смещается в сторону снижения давления, т.е. вправо, т.к. меньшее число молекул газа оказывают меньшее давление;
г) равновесие не смещается, т.к. катализатор увеличивает скорость прямой и обратной реакции в одинаковое число раз.
2) Константа равновесия для реакции окисления оксида серы (IV): 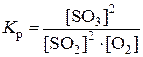 .
.
Задачи для самостоятельного решения
Вариант 1
1. Составьте математическое выражение закона действия масс для следующего процесса: Zn(к) + H2O(пар) ® ZnO(к) + H2 (г).
2. Как изменится скорость реакции: СО (г)+ О2(г) ® СО2(г); DН < 0, если: а)концентрацию СО увеличить в 2 раза; б) температуру процесса повысить на 30°С (g = 2).
3. В какую сторону сместится равновесие этой химической реакции, если: а) повысить температуру; б) увеличить давление; в) внести катализатор; г) увеличить концентрацию СО2?
4. Составьте выражение константы химического равновесия для процесса 2.
Вариант 2
1. Составьте математическое выражение закона действия масс для следующего процесса: СаО(тв) + H2SO4(р-р) ® CaSO4(р-р) + H2O(ж).
2. Как изменится скорость химической реакции: SO2(г) + O2(г) ® SO3(г), если а) концентрацию О2 увеличить в 4 раза; б) температуру процесса повысить на 40°С (g = 3)?
3. В какую сторону сместится равновесие химической реакции: NO(г) + O2(г) ® NO2(г); DH < 0, если: а) снизить температуру; б) увеличить давление; в) внести катализатор; г) увеличить концентрацию NO?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 3
1. Составьте математическое выражение закона действия масс для следующего процесса: Zn(к) + HCl(р-р) ® ZnCl2(р-р) + H2(г).
2. Как изменится скорость химической реакции: NO(г) + O2(г) ® NO2(г), если: а) концентрацию NO уменьшить в 3 раза; б) температуру процесса повысить на 20°С (g = 3)?
3. В какую сторону сместится равновесие химической реакции: SO2(г) + O2(г) ® SO3 (г); DН < 0, если: а) снизить температуру; б) увеличить давление; в) внести катализатор; г) увеличить концентрацию SO3?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 4
1. Составьте математическое выражение закона действия масс для следующего процесса: C(к) + О2(г) ® СО(г).
2. Как изменится скорость химической реакции: O2(г) + H2(г) ® H2O(г), если: а) концентрацию Н2 уменьшить в 2 раза; б) температуру процесса повысить на 60°С (g = 3)?
3. В какую сторону сместится равновесие химической реакции: H2(г) + O2(г) ® H2O(г); DН < 0, если: а) снизить температуру; б) увеличить давление; в) ввести катализатор; г) уменьшить концентрацию Н2О?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 5
1. Составьте математическое выражение закона действия масс для следующего процесса: Mg(к) + O2(г) ® MgO(к).
2. Как изменится скорость химической реакции: SO2(г) + O2(г) ® SO3(г), если а) концентрацию SO2 увеличить в 3 раза; б) температуру процесса понизить на 40°С (g = 3)?
3. В какую сторону сместится равновесие химической реакции: H2(г) + Br2(г) ® HBr(г); DH < 0, если: а) снизить температуру; б) увеличить давление; в) ввести катализатор; г) уменьшить концентрацию Br2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 6
1. Составьте математическое выражение закона действия масс для следующего процесса: H2S(г) + SO2(г) ® S(г) + H2O(ж).
2. Как изменится скорость химической реакции: N2(г) + O2(г) ® NO(г), если а) концентрацию О2 уменьшить в 4 раза; б) температуру процесса повысить на 30°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции: СаСО3(к) ® СаО(к) + СО2(г); DН > 0, если: а) повысить температуру; б) увеличить давление; в) ввести катализатор; г) увеличить концентрацию СО2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 7
1. Составьте математическое выражение закона действия масс для следующего процесса: Fe(к) + CuSO4(р-р) ® Cu(к) + FeSO4 (р-р).
2. Как изменится скорость химической реакции: N2(г) + H2(г) ® NH3(г), если а) концентрацию N2 увеличить в 2 раза; б) температуру процесса повысить на 40°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции: H2(г) + Сl2(г) ® НСl(г); DН < 0, если: а) снизить температуру; б) увеличить давление; в) ввести катализатор; г) уменьшить концентрацию Сl2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 8
1. Составьте математическое выражение закона действия масс для следующего процесса: CaO(к) + CO2(г) ® CaCO3(к).
2. Как изменится скорость химической реакции: H2S(г) + SO2(г) ® S(к) + H2O(ж), если: а) концентрацию H2S уменьшить в 3 раза; б) температуру процесса повысить на 30°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции: HI(г) ® H2(г) + I2(г); DН > 0, если: а) снизить температуру; б) увеличить давление; в) ввести катализатор; г) уменьшить концентрацию HI?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 9
1. Составьте математическое выражение закона действия масс для следующего процесса: Са(к) + Н2О(ж) ® Са(ОН)2(р-р) + Н2 (г).
2. Как изменится скорость химической реакции: CO2(г) + C(к) ® CO(г), если а) концентрацию СО2 уменьшить в 2 раза; б) температуру процесса повысить на 40°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции: NO(г) + О2(г) ® NO2(г); DН < 0, если: а) снизить температуру; б) уменьшить давление; в) ввести катализатор; г) уменьшить концентрацию NO2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 10
1. Составьте математическое выражение закона действия масс для следующего процесса: FeO(к) + СO(г) ® Fe(к) + СО2(г).
2. Как изменится скорость химической реакции: H2(г) + I2(г) ® HI(г), если: а) уменьшить концентрацию Н2 в 2 раза; б) повысить температуру процесса на 60°С (g = 4)?
3. В какую сторону сместится равновесие химической реакции: Mg(к) + CO2(г) ® MgO(к) + CO(г); DН < 0, если: а) повысить температуру; б) увеличить давление; в) ввести катализатор; г) уменьшить концентрацию СО2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 11
1. Составьте математическое выражение закона действия масс для следующего процесса: Fe2O3(к) + CO(г) ® FeO(к) + CO2(г).
2. Как изменится скорость химической реакции: C(к) + O2(т) ® CO2(г), если а) концентрацию О2 увеличить в 3 раза; б) температуру процесса понизить на 20°С (g = 3)?
3. В какую сторону сместится равновесие химической реакции: CH4(г) + O2(г) ® CO2(г) + H2O(г); DH < 0, если а) повысить температуру; б) увеличить давление; в) ввести катализатор; г) увеличить концентрацию О2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 12
1. Составьте математическое выражение закона действия масс для следующего процесса: SO2(г) + Li2O(к) ® Li2SO3(к).
2. Как изменится скорость химической реакции: Н2(г) + S(к) ® Н2S(г), если: а) концентрацию Н2 уменьшить в 4 раза; б) температуру процесса повысить на 30 °С (g = 2)?
3. В какую сторону сместится равновесие химической реакции: SnO(к) + H2(г) ® Sn(к) + H2O(г); DН > 0, если: а) повысить температуру; б) уменьшить давление; в) ввести катализатор; г) уменьшить концентрацию Н2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 13
1. Составьте математическое выражение закона действия масс для следующего процесса: CaO(к) + CO2(г) ® СaCO3(к).
2. Как изменится скорость химической реакции: H2S(г) + O2(г) ® S(к) + H2O(г), если: а) концентрацию сероводорода увеличить в 2 раза; б) температуру процесса повысить на 40°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции: С(к) + H2O(г) ® CO(г) + H2(г); DН > 0, если а) повысить температуру; б) уменьшить давление; в) внести катализатор; г) уменьшить концентрацию СО?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 14
1. Составьте математическое выражение закона действия масс для следующего процесса: Н2О(ж) + Li2O(к) ® LiOH(р-р).
2. Как изменится скорость химической реакции: H2(г) + Cl2(г) ® HCl(г), если: а) концентрацию Н2 увеличить в 2 раза; б) температуру процесса повысить на 30°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции: Н2(г) + С(графит) ® СН4(г); DН < 0, если: а) снизить температуру; б) уменьшить давление; в) внести катализатор; г) уменьшить концентрацию Н2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 15
1. Составьте математическое выражение закона действия масс для следующего процесса: Cu(к) + HNO3(р-р) ® Cu(NO3)2(р-р) + NO(г) + H2O(ж).
2. Как изменится скорость химической реакции: H2S(г) + O2(г) ® SO2(г) + H2O(г), если: а) концентрацию О2 уменьшить в 3 раза; б) температуру процесса повысить на 40°С (g = 3)?
3. В какую сторону сместится равновесие химической реакции: СН4(г) + Н2О(г) ® СО(г) + Н2(г); DН < 0, если а) снизить температуру; б) уменьшить давление; в) внести катализатор; г) увеличить концентрацию Н2.
4. Составьте выражение константы химического равновесия для процесса 3.
Тестовые задания для самоконтроля
1. Скорость химической реакции А + 2В = АВ 2 … если концентрацию вещества В увеличить в 2 раза.
1) увеличится в 2 раза;
2) уменьшится в 2 раза;
3) увеличится в 4 раза.
2. Реакция, которая идет на границе раздела фаз -
1) гомогенная;
2) гетерогенная;
3) экзотермическая.
3. Если температурный коэффициент реакции равен 3, то скорость реакции при повышении температуры на 20°…
1) увеличится в 3 раза;
2) уменьшится в 9 раз;
3) увеличится в 9 раз.
4. Равновесие реакции 2CO(г) + O2(г) = 2CO2(г); –∆Н при а) повышении давления, б) понижении температуры сместится:
1) а) →, б) →;
2) а) ←, б) ←;
3) а) →, б) ←.
5. Скорость реакции увеличивается в 2-4 раза при повышении температуры на каждые 10° - это:
1) закон действия масс;
2) принцип Ле-Шателье;
3) правило Вант-Гоффа.
6. Скорость реакции пропорциональна концентрации реагирующих веществ в степени их стехиометрических коэффициентов – это:
1) Закон действия масс;
2) Правило Вант-Гоффа;
3) Принцип Ле-Шателье.
7. Константа скорости химической реакции не зависит от…
1) природы реагирующих веществ;
2) концентрации реагирующих веществ;
3) температуры.
8. Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие –
1) закон действия масс;
2) принцип Ле-Шателье;
3) правило Вант-Гоффа.
9. Смещение химического равновесия не зависит от:
1) концентрации реагирующих веществ;
2) присутствия катализатора;
3) температуры.
10. Механизм действия катализатора объясняется …
1) увеличением доли активных молекул;
2) увеличением скорости движения молекул;
3) понижением энергии активации реакции за счет образования промежуточного комплекса катализатора с реагирующим веществом.
Ответы к тестовым заданиям
| № вопроса | ||||||||||
| № ответа |
Лабораторная работа № 5
Скорость химической реакции. Катализ
Цель работы: рассмотреть влияние концентрации и температуры реагирующих веществ на скорость химической реакции и смещение химического равновесия.
Реактивы: растворы Na2S2O3 (1 н.), H2SO4 (2 н.), FeCl3 (разб.), FeCl3 (насыщ.), KSCN (разб.), KSCN (насыщ.), H2O2 (3%); KCl (тв.). MnO2 (тв.).
Оборудование: штатив с пробирками, водяная баня, электроплитка, держатель для пробирок, микрошпатель, стеклянная палочка, термометр, лучинка.
Ход работы
Опыт 1. Влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной среде
Взаимодействие тиосульфата натрия (Na2S2O3) с серной кислотой протекает по уравнению:
| Na2S2O3 + H2SO4 → Na2SO4 + S↓ + SO2 + H2O |
Cкорость реакции при постоянной температуре зависит от концентрации H2S2O3 и H2SO4.
Для опыта необходимо иметь три раствора тиосульфата натрия различной концентрации. Из имеющегося 1 н раствора разбавлением готовятся еще два. Для этого в первую сухую пробирку внесите 4 капли 1 н. раствора тиосульфата натрия и 8 капель воды, во вторую – 8 капель 1 н. раствора тиосульфата натрия и 4 капли воды, пробирки осторожно встряхнуть. В третью пробирку налейте 12 капель исходного 1 н раствора тиосульфата натрия. Концентрации растворов в пробирках относятся как 1 : 2 : 3. К полученным растворам добавляем по 1 капле серной кислоты.
Время реакции фиксируется по секундомеру от момента падения капли серной кислоты в раствор тиосульфата натрия до помутнения раствора (появления коллоидной серы).
Полученные данные опыта запишите в таблицу 6.1.
Таблица 6.1
Экспериментальные данные по влиянию концентрации реагирующих веществ на скорость химической реакции
| № пробирки | Число капель раствора Na2S2O3 | Число капель H2O | Число капель H2SO4 | Концентрация Na2S2O3, моль | Время течения реакции, τ, с | Скорость реакции в условных единицах (1/τ) |
| 1C | ||||||
| 2C | ||||||
| 3C |
По полученным данным постройте график зависимости обратного времени (величины пропорциональной скорости реакции) от концентрации тиосульфата натрия (рис. 6.5).
Сформулируйте вывод о влиянии концентрации реагирующего вещества на скорость реакции.

Рис. 6.5. График зависимости относительной скорости реакции от концентрации реагирующих веществ
Опыт 2. Изучение влияния концентрации реагирующих веществ на химическое равновесие
В данном опыте изучают обратимую реакцию взаимодействия хлорида железа (III) с роданидом калия:
FeCl3 + 3 KCNS D Fe(CNS)3 + 3KCl.
Роданид железа Fe(CNS)3 придает раствору кроваво-красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации Fe(CNS)3, т.е. о смещении равновесия в ту или иную сторону.
В пробирку налейте 4 мл дистиллированной воды, затем внесите по 8 капель разбавленных растворов хлорида железа (III) FeCl3 и роданида калия KCNS. Легким встряхиванием пробирки размешайте раствор. Разлейте полученный раствор на 4 пробирки. Первую пробирку оставьте в качестве эталона исходного цвета раствора. Во вторую пробирку добавьте 2 капли насыщенного раствора хлорида железа (III) (FeCl3), в третью пробирку добавьте 2 капли насыщенного раствора роданида калия (KCNS), в четвертую пробирку добавьте несколько кристаллов хлорида калия (KCl). Растворы размешайте встряхиванием.
При оформлении отчета запишите уравнение реакции между FeCl3 и KCNS и выражение константы равновесия данной реакции.
В таблице 6.2. отметьте изменение интенсивности окраски в каждом случае. С помощью стрелочек (→ или ←) покажите, в каком направлении смещается равновесие при добавлении: хлорида железа (III), роданида калия, хлорида калия. Сформулируйте вывод по результатам опыта.
Таблица 6.2
Экспериментальные данные по влиянию концентрации веществ
на смещение химического равновесия
| № пробирки | Добавляемое вещество | Изменение интенсивности окраски раствора | Направление смещения равновесия |
| ЭТАЛОН | |||
| FeCl3 (насыщ.) | |||
| KCNS (насыщ.) | |||
| KCl (крист.) |
Дата добавления: 2017-11-21; просмотров: 3623;











