Характеристика свойств веществ в твердом состоянии
Вещество, имеющее форму и оказывающее сопротивление всякому действию, направленному на изменение формы, называется твердым. Твердые вещества, имеющие постоянную температуру плавления – кристаллические, не имеющие постоянной температуры плавления, а размягчающиеся постепенно при нагревании в некотором интервале температур с переходом в жидкость – аморфные.
Кристаллы состоят из закономерно расположенных в пространстве молекул, атомов или ионов, которые образуют пространственную кристаллическую решетку.
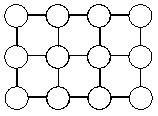
Атомные решетки состоят из атомов. Такие кристаллические решетки характерны для неметаллов – углерода, бора, кремния, их соединений – карбидов, нитридов, фосфидов и др. Атомные решетки очень прочны. Эти вещества обладают большой твердостью, плавятся при очень высоких температурах (у алмаза tпл = 3500°С, у карбида кремния – 3000°С), практически не растворимы ни в каких растворителях. Такие свойства обусловлены прочностью ковалентной связи, образующейся за счет перекрывания облаков неспаренных электронов атомов неметаллов.
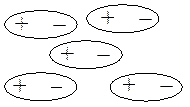
Молекулярные решетки характерны для многих неорганических веществ с ковалентным типом связи, для всех органических веществ. Они образованы молекулами, связанными между собой межмолекулярными силами (силы Ван-дер-Ваальса, водородная связь), которые значительно слабее ковалентных. Поэтому этим веществам присущи небольшая твердость, сравнительная легкоплавкость, летучесть.
Молекулы, имеющие полярные группы, связаны несколько большими межмолекулярными силами. Температуры плавления, кипения, растворимость в полярных растворителях у таких веществ выше, кристаллические решетки прочнее.
| 
|
| Атомная | Молекулярная |

| 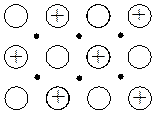
|
| Ионная | Металлическая |
Рис. 4.15. Типы кристаллических решеток.
Ионные решетки присущи большинству солей и оксидам металлов. Они построены из ионов, между которыми действуют электростатические силы. Каждый ион окружен атмосферой противоионов, что обеспечивает устойчивость кристаллов, уменьшая силы отталкивания между одноименными ионами. По прочности они занимают промежуточное положение между атомными и молекулярными кристаллическими решетками. При обычных условиях ионные кристаллы – твердые вещества, они имеют высокие температуры плавления, но небольшую летучесть. В полярных растворителях ионные кристаллы растворяются, ионная решетка при этом сравнительно легко разрушается.
Металлические решетки характерны для металлов. Они образованы положительными ионами и атомами металла, между которыми движутся свободные электроны – электронный газ (подробнее о кристаллическом строении металлов см. тему «Металлы»).
Дата добавления: 2017-11-21; просмотров: 1118;











