Влияние температуры на скорость химической реакции
Не всякое столкновение между молекулами приводит к образованию новых веществ. Химическое взаимодействие происходит только между активными молекулами, обладающими большей энергией, чем средняя энергия молекул в системе. В любой системе молекулы отличаются друг от друга энергией. Распределение молекул по скоростям и энергиям представлено графически (рис. 6.1) в виде кривой с максимумом, начинающейся из начала координат, и не пересекающей ось ординат. Оно называется распределением Максвелла-Больцмана. Максимум кривой отражает долю молекул со средним значением энергии. С повышением температуры (Т2>Т1) возрастает энергия молекул и доля активных молекул, столкновение которых может привести к взаимодействию.
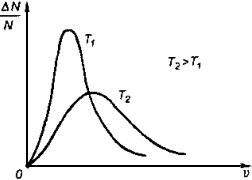
Рис. 6.1.Распределение молекул по энергиям (распределение Максвелла-Больцмана).
Избыток энергии молекул необходимый, для того чтобы реакция началась, называется энергией активации.
Реакция начинается с разрыва или ослабления связей в молекулах реагирующих веществ, что требует энергетических затрат. Реагирующие вещества образуют неустойчивое промежуточное соединение, называемое активированным комплексом.
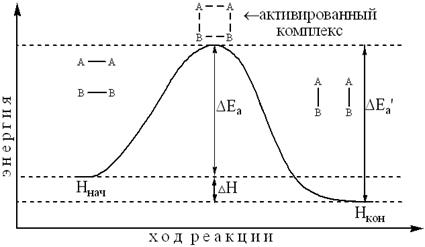
Рис. 6.2. Изменение энергии реакции. (Ннач – энергия исходного состояния (исходных веществ), Нкон – энергия конечного состояния (продукты реакции), ΔН – тепловой эффект реакции, Ea΄ – энергия активации обратной реакции, Ea – энергия активации прямой реакции).
С повышением температуры увеличивается доля активных молекул в системе, а следовательно, и число результативных столкновений.
Скорость реакции увеличивается в 2–4 раза при повышении температуры на каждые 10 градусов (правило Вант-Гоффа).
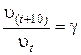 , ,
| (6.4) |
где g – температурный коэффициент реакции, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов; υt, υ(t+10) – скорости реакции при температурах, отличающихся на 10 градусов.
Более точно влияние температуры описывается экспериментально полученным уравнением Аррениуса:
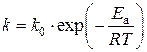
| (6.5) |
где k – константа скорости реакции; Еа – энергия активации, определяемая природой реакции; k0 – предэкспоненциальный множитель, описывающий число результативных столкновений молекул (А) и благоприятную их ориентацию относительно друг друга, определяемую стерическим фактором (Р): k0 = А·Р .
Для результативного столкновения активных молекул часто необходимо определенная ориентация в пространстве их функциональных групп. Поэтому реальное число результативных столкновений бывает меньше числа активных молекул.
Дата добавления: 2017-11-21; просмотров: 1584;











