Периодический закон Д.И. Менделеева
В 1869 году Д.И. Менделеев сообщил об открытии периодического закона, современная формулировка которого следующая: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Исследованиями английских ученых Г. Мозли и Дж. Чедвика было установлено, что порядковый номер элемента равен заряду ядра атома.
3.3.1. Протонно-нейтронная модель строения ядра сформулирована в 1932г. отечественным ученым Д.Д. Иваненко. Суть теории в том, что ядро состоит из Z – протонов (1р1) и (А – Z) – нейтронов (0n1), где А – атомная масса элемента.
3.3.2. Периодическая система Д.И. Менделеева служит графическим выражением периодического закона.
Элементы в системе располагаются в порядке возрастания заряда их ядер. Они формируют горизонтальные и вертикальные ряды. Горизонтальные ряды – периоды: I-III – малые, IV-VI – большие, VII – незаконченный. Второй и третий периоды содержат по 8 элементов, называются типическими. У элементов одного периода заполняется одинаковое число энергетических уровней равное главному квантовому числу последнего (внешнего) уровня. Начало периода совпадает с началом формирования нового энергетического уровня. Начинаются периоды щелочными металлами, имеющими один ē на внешнем уровне, заканчиваются инертными газами, которые имеют восемь электронов на внешнем уровне. Большие периоды делятся на 2 ряда. В четных радах на внешнем слое у элементов находится 1-2 ē, т.к. заполняется d-подуровень предвнешнего уровня. Свойства элементов меняются медленно. В нечетных рядах идет заполнение внешнего уровня до 8 ē, как у типических элементов.
В Периодической системе элементов имеется восемь групп. Принадлежность элемента к группе определяется числом валентных электронов, как правило, равным номеру группы. Группы делятся на главные и побочные подгруппы. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги). Главные подгруппы (подгруппы А) образованы элементами малых и больших периодов. Побочные подгруппы (подгруппы В) образованы элементами только больших периодов (d- и f-элементы). Первые шесть d-элементов (от Sc до Fe) начинают соответствующие подгруппы. В подгруппу VIII Б также включаются все элементы семейства железа (Fe, Со, Ni) и их аналоги – платиновые металлы. Медь и ее аналоги, имеющие во внешнем s-подуровне по одному электрону, образуют 1 Б подгруппу, цинк и его аналоги – 2 Б подгруппу. Лантаноиды и актиноиды (f-элементы), принадлежащие к III Б подгруппе, обычно вынесены в «подвал» таблицы.
Международный союз теоретической и прикладной химии (IUPAC) c 1989 года утвердил в качестве основного варианта периодической системы длиннопериодную форму (см. таблицу приложения № ), в которой рекомендуется сплошная нумерация групп арабскими цифрами (1 – 18). В данном пособии авторы по методическим соображениям опираются на традиционную короткопериодную форму периодической системы, поскольку ее проще использовать при составлении электронных формул атомов элементов. Например, студенту проще определять число валентных электронов в атоме элемента, как правило равное номеру группы короткопериодной формы системы.
3.3.3. Электронная конфигурация элемента.
Запись распределения электронов в атоме по энергетическим уровням, подуровням и орбиталям получила название электронной конфигурации элемента. Обычно электронная конфигурация приводится для основного состояния атома. Если один или несколько электронов находятся в возбужденном состоянии, то и электронная конфигурация будет характеризовать возбужденное состояние атома. При записи электронной конфигурации цифрами указывают главное квантовое число (n), буквами – подуровни (s, р, d или f), а степень буквенных обозначений подуровней обозначает число электронов в данном подуровне. Например, электронная конфигурация водорода – 1s1, лития – 1s22s1, бора – 1s22s22р1.
3.3.4. Изменение свойств элементов в периодах и группах.
Все свойства элементов, определяемые строением электронных уровней атома, закономерно изменяются в периодах и группах периодической системы.
Последовательно изменяются свойства:
1) заряд ядра;
2) общее число электронов;
3) масса ядра атома (Σp + Σn = A). (Атомы, имеющие различное количество нейтронов в ядре, а следовательно и разные атомные массы – изотопы);
4) число энергетических уровней.
Периодически изменяются:
1) валентность элементов и количество валентных электронов;
2) радиус атомов;
3) окислительно-восстановительные свойства атомов.
3.3.4.1. Атомные радиусы.
Вследствие волнового характера движения электронов атом не имеет строго определенных границ. За радиус атома принимается теоретически рассчитанное положение главного максимума плотности внешних электронных облаков.
Радиус атомов в группах увеличивается, причем, в главных подгруппах больше, чем в побочных. Так разница атомных радиусов между элементами четвертого и шестого периодов в VА подгруппе (As–Bi) Dr = 0,034 нм (нанометр), а в V Б подгруппе (V–Ta) Dr = 0,012 нм.
Радиус атомов в периодах уменьшается. В больших периодах в пределах семейств d- и f-элементов наблюдается постепенное уменьшение радиусов. Это уменьшение называется соответственно d- и f-сжатием.
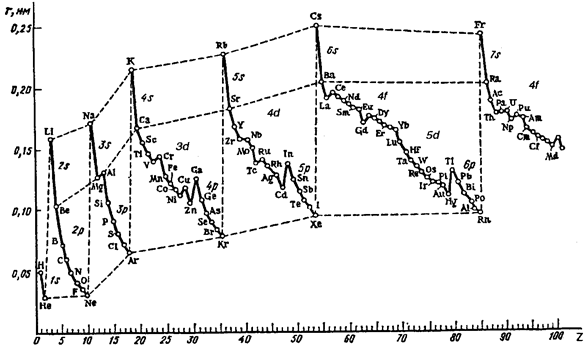 Рис. 3.4. Зависимость орбитальных радиусов атомов от порядкового номера элементов
Рис. 3.4. Зависимость орбитальных радиусов атомов от порядкового номера элементов
3.3.4.2. Окислительно-восстановительные свойства атомов элементов.
Энергетический выигрыш сопровождает переход атома к устойчивому состоянию электронных конфигураций: p0,3,6; d0,5,10; f0,7,14. Переход в устойчивое состояние (например, 8ē конфигурация внешнего слоя – s2р6) может осуществляться путем отдачи или присоединения электронов. Если на внешнем уровне 1–2ē, то устойчивое состояние достигается отдачей электронов, если внешний уровень содержит 5–7 электронов, то – присоединением.
Процесс отдачи электронов – окисление, присоединение – восстановление. Восстановительные свойства атомов определяются способностью отдавать электроны. Восстановительные свойства характеризуются энергией ионизации – энергия, необходимая для отрыва электрона от атома и превращения его в положительный ион, обозначается – I, измеряется в кДж/моль (Э0 –ē → Э1+ –I).
В периодах энергия ионизации увеличивается не монотонно, так как конфигурации s2 и p3 более устойчивы, для отрыва электрона в этих случаях требуется большая энергия ионизации (рис. 3.5). В группах с ростом радиуса атома энергия ионизации уменьшается, что легко объяснить с позиций закона Кулона: сила притяжения к ядру уменьшается обратно пропорционально квадрату расстояния между зарядами (чем дальше электрон от ядра тем легче его оторвать). Самое низкое значение энергии ионизации у щелочных металлов, самое высокое – у инертных газов у которых в устойчивой электронной конфигурации находится восемь электронов (сила взаимодействия зарядов пропорциональна их величине). В побочных подгруппах, в отличие от главных, восстановительные свойства элементов (сверху вниз) ослабевают из-за d-сжатия.
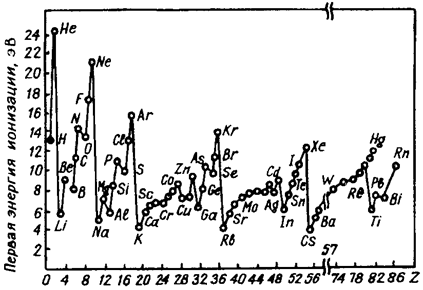
Рис. 3.5.Зависимость первой энергии ионизации от порядкового номера элемента Z
Окислительные свойства характеризуются энергией сродства к электрону– энергией выделяющейся при присоединении электрона к атому, обозначается – Е (кДж/моль). Э0 +ē → Э1– +Е.
В периодах энергия сродства к электрону растет, в группах падает. Наибольшие значения сродства к электрону имеют галогены, кислород, сера, а наименьшие и даже отрицательные значения ее – элементы с электронной конфигурацией s2 (Не, Be, Mg, Zn), с полностью или наполовину заполненными р-подуровнями (Ne, Ar, Kr, N, Р, As).
Для характеристики окислительно-восстановительных свойств атомов вводится понятие электроотрицательности. Электроотрицательность (ЭО) равна полусумме энергий ионизации и сродства к электрону:
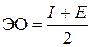 . .
| (3.8) |
Например, для фтора: 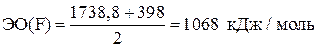 .
.
Для сравнения свойств различных элементов более удобно пользоваться относительной электроотрицательностью (ОЭО), которая показывает, во сколько раз ЭО элемента отличается от ЭО лития. ЭО лития принята за единицу. У фтора самая высокая ОЭО, она равна четырем. ОЭО характеризует способность атома притягивать к себе электроны. Чем выше значение ОЭО, тем сильнее окислительные свойства элемента и слабее восстановительные. В периодах ОЭО растет, в главных подгруппах – падает.
Дата добавления: 2017-11-21; просмотров: 1352;











