Гибридизация атомных орбиталей
Американский ученый Л. Полинг выдвинул идею о гибридизации атомных орбиталей. Согласно этой идее, если у атома, вступающего в химическую связь, имеются разные атомные орбитали (АО) (s-, p-, d- или f-АО), то в процессе образования химической связи происходит гибридизация АО. Т.е. из разных АО образуются одинаковые (эквивалентные) АО. У атома гибридизуются орбитали, которые имеют близкие значения энергий. Идея о гибридизации АО – это удобный и наглядный прием описания сложных процессов, происходящих при образовании химических соединений. Форма гибридной АО отличается от формы исходных АО (рис. 4.3).
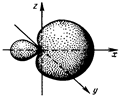
Рис. 4.3. Атомная sp-гибридная орбиталь
В гибридной АО электронная плотность смещается в одну сторону от ядра. При взаимодействии гибридной орбитали с АО другого атома происходит перекрывание в области максимальной электронной плотности, что приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
Если в химическую связь вступает атом, у которого на внешнем валентном уровне имеются один s- и один p-электроны, то у данного атома в процессе образования связи происходит sp-гибридизация АО (рис. 4.4).
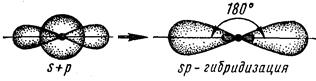
Рис. 4.4. Схема sp-гибридизации
Если у атома, вступающего в химическую связь, на внешней оболочке имеются один s- и два p-электрона, то помимо sp-гибридизации может происходить sp2-гибридизация АО этого атома (рис. 4.5).
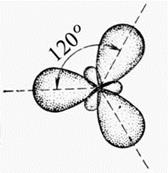
Рис. 4.5. Схема sp2-гибридизации
У атома, имеющего на внешней оболочке один s- и три р-электрона, при химическом взаимодействии помимо sp- и sp2-гибридизации, может происходит sp3-гибридизация этих АО (рис. 4.6).
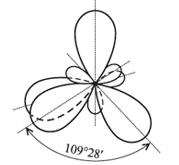
Рис. 4.6. Схема sp3-гибридизации
Возможны также более сложные виды гибридизации с участием d-орбиталей атомов (табл. 4.3).
Как видно из рис 4.4-4.6, гибридные облака в пространстве располагаются симметрично относительно друг друга, что уменьшает их взаимное отталкивание и соответственно понижает энергию молекул.
Таблица 4.3
Пространственная конфигурация некоторых соединений
| Тип гибридизации центрального атома | Конфигурация молекулы | Угол между связями, град | Примеры соединений |
| sp | Линейная | SnCl2, BeF2 | |
| sp2, dp2, sd2 | Плоская тригональная | BCl3, AlF3 | |
| sp3, sd3 | Тетраэдр | 109°28′ | CH4, SiH4 |
| dsp2 | Плоский квадрат | [PdBr4]– | |
| dsp3 | Тригональная бипирамида | PF5 | |
| d2sp3 | Октаэдр | SF6, [SbCl6]– | |
| d4sp3 | Додекаэдр | [Mo(CN)8]4– |
4.1.4.2. Образование σ-, π- и δ-связей
В зависимости от направления перекрывания электронных облаков образуются s-, p- и δ-связи.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется s-связью. Сигма-связь может возникать при перекрывании двух s-орбиталей (рис. 4.7), s- и p-орбиталей, p-орбиталей между собой, d-орбиталей, а также d- и s-орбиталей, d- и p-орбиталей, а также перекрыванием гибридных орбиталей с другими видами орбиталей и между собой. Сигма-связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
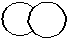 s-s
s-s
| 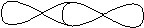 p-p
p-p
| 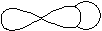 p-s
p-s
|
 spn-s
spn-s
|  d-spn
d-spn
|  spn-spn
spn-spn
|
Рис. 4.7. Перекрывание атомных орбиталей при образовании σ-связей
Связь, образованная перекрыванием негибридных р- и d-АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р-р-орбиталей, р-d – орбиталей, d-d-орбиталей (рис. 4.8), а также f-p-, f-d- и f-f-орбиталей.
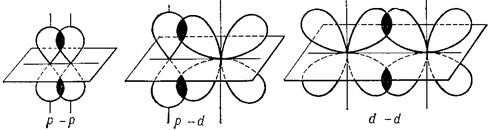
Рис. 4.8.Перекрывание атомных орбиталей при образовании π-связей
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью (рис. 4.9).
Соответственно, s-элементы могут образовывать только σ-связи, p-элементы – σ- и π-связи, d-элементы σ-, π-, и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.

Рис. 4.9.Направление перекрывания атомных d-орбиталей при образовании δ-связей
Дата добавления: 2017-11-21; просмотров: 3616;











