Номенклатура, получение и химические свойства неорганических веществ
2.3.1. Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления, равной –2. Общая формула любого оксида – ЭхОу–2. Различают солеобразующие (основные: Li2O, CaO, MgO, FeO; амфотерные: ZnO, Al2O3, SnO2, Cr2O3, Fe2O3; кислотные: B2O3 , SO3 , CO2, P2O5, Mn2O7) и несолеобразующие: N2O, NO, CO оксиды. Элементы с переменной степенью окисления образуют несколько оксидов (MnO, MnO2, Mn2O7, NO, N2O3, NO2, N2O5). В высшем оксиде, как правило, элемент находится в степени окисления, равной номеру группы.
По современной номенклатуре названия оксидов составляют следующим образом: слово «оксид», далее русское название элемента в родительном падеже, степень окисления элемента, если она переменная, римскими цифрами в скобках. Например: FeO – оксид железа (II), P2O5 – оксид фосфора (V).
2.3.1.1.Основные оксиды это те оксиды, которым соответствуют гидроксиды – основания. Основными называют оксиды, взаимодействующие с кислотами с образованием соли и воды. Основные оксиды образуются только металлами в степени окисления +1, +2 (иногда +3), например: BaO, SrO, FeO, MnO, CrO, Li2O, Bi2O3, Ag2O.
Получение основных оксидов:
1) Окисление металлов при нагревании в атмосфере кислорода:
2Mg + O2 = 2MgO,
2Cu + O2 = 2CuO.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2O, K2O крайне труднодоступны.
2) Обжиг сульфидов:
2СuS + 3O2 = 2CuO + 2SO2,
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
3) Разложение гидроксидов:
Cu(OH)2 = CuO + H2O.
Этим методом нельзя получить оксиды щелочных металлов.
4) Разложение солей некоторых кислородсодержащих кислот:
BaCO3 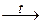 BaO + CO2,
BaO + CO2,
2Pb(NO3)2 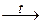 2PbO + 4NO2 + O2
2PbO + 4NO2 + O2
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера; в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с ионами O2–, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава, и могут существовать смешанные оксиды переменного состава.
1) Отношение к воде.
Процесс присоединения воды называется гидратацией, а образующееся вещество – гидроксидом. Из основных оксидов с водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных металлов (Ca, Sr, Ba, Ra):
Li2O + H2O = 2LiOH,
BaO + H2O = Ba(OH)2.
Большинство же основных оксидов в воде не растворяются и не взаимодействуют с ней. Соответствующие их гидроксиды получают косвенным путем – действием щелочей на соли (см. ниже).
2) Отношение к кислотам.
CaO + H2SO4 = CaSO4 + H2O,
FeO + 2HCl = FeCl2 + H2O.
3) Отношение к кислотным и амфотерным оксидам.
Основные оксиды щелочных и щелочноземельных металлов при сплавлении взаимодействуют с твердыми кислотными и амфотерными оксидами, а также с газообразными кислотными оксидами при обычных условиях.
CaO + CO2 = CaCO3,
3BaO + P2O5 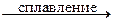 Ba3(PO4)2,
Ba3(PO4)2,
Li2O + Al2O3 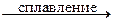 2LiAlO2.
2LiAlO2.
Основные оксиды менее активных металлов взаимодействуют только с твердыми кислотными оксидами при сплавлении.
2.3.1.2.Кислотные оксиды – оксиды, которые при взаимодействии с основаниями образуют соль и воду. Кислотным оксидам соответствуют гидроксиды – кислоты. Кислотные оксиды – это оксиды неметаллов в различных степенях окисления, либо оксиды металлов в высокой степени окисления (+4 и выше). Примеры: SO2, SO3, Cl2O7, Mn2O7, CrO3.
Химическая связь в кислотных оксидах – ковалентная полярная. При обычных условиях кислотные оксиды неметаллов могут быть газообразными (CO2, SO2), жидкими (N2O3, Cl2O7), твердыми (P2O5, SiO2).
Получение кислотных оксидов
1)Окисление неметаллов:
S + O2 = SO2↑.
2)Окисление сульфидов:
2ZnS + 3O2 = 2ZnO + 2SO2↑.
3) Вытеснение непрочных слабых кислот из их солей:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O.
Свойства кислотных оксидов
1) Отношение к воде.
Большинство кислотных оксидов растворяются в воде, вступая с ней в химическое взаимодействие и образуя кислоты:
SO3 + H2O = H2SO4,
CO2 + H2O = H2CO3.
2) Отношение к основаниям.
Кислотные оксиды взаимодействуют с растворимыми основаниями – щелочами, образуя соль и воду.
SO2 + 2NaOH = Na2SO3 + H2O,
P2O5 + 6NaOH 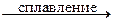 2Na3PO4 + 3H2O.
2Na3PO4 + 3H2O.
3) Отношение к основным и амфотерным оксидам.
Твердые кислотные оксиды взаимодействуют с основными и амфотерными оксидами при сплавлении. Жидкие и газообразные оксиды взаимодействуют с оксидами щелочных и щелочноземельных металлов при обычных условиях.
P2O5 + 3CuO 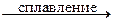 Cu3(PO4)2,
Cu3(PO4)2,
3SiO2 + Al2O3 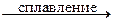 Al2(SiO3)3.
Al2(SiO3)3.
2.3.1.3. Амфотерные оксиды взаимодействуют и с кислотами и со щелочами, проявляя свойства кислотных и основных оксидов. Им соответствуют амфотерные гидроксиды. Все они твердые вещества, нерастворимые в воде. Примеры амфотерных оксидов: ZnO, BeO, SnO, PbO, Al2O3, Cr2O3, Sb2O3, MnO2.
Свойства амфотерных оксидов
Амфотерные оксиды реагируют с кислотами как основные:
Al2O3 + 6HCl = 2AlCl3 + 3H2O,
а со щелочами – как кислотные. Состав продуктов реакции зависит от условий. При сплавлении:
ZnO + 2NaOH = Na2ZnO2 + H2O.
цинкат натрия
В растворе щелочи образуется растворимая комплексная соль, содержащая гидроксокомплексный ион:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4].
тетрагидроксоцинкат натрия
2.3.1.4. Несолеобразующие оксиды – это оксиды неметаллов, которым не соответствуют гидроксиды и соли. Примеры: CO, N2O, NO, SiO. Для этих оксидов характерны окислительно-восстановительные реакции.
Оксиды широко распространены в природе. Так вода – самый распространенный оксид покрывает 71% поверхности планеты. Оксид кремния (IV) в виде 400 разновидностей кварца составляет 12% от массы земной коры. Оксид углерода (IV) (углекислый газ) содержится в атмосфере – 0,03% по объему, а также в природных водах. Важнейшие руды: гематит, магнетит, бурый железняк состоят из различных оксидов железа. Бокситы содержат оксид алюминия, и т.д.
2.3.2.Основания– сложные вещества, в которых на атом металла приходится одна или несколько гидроксогрупп ОН–. Степень окисления атомов металла обычно +1, +2 (реже +3). Общая формула оснований Ме(ОН)х, где х – число гидроксогрупп – кислотность основания. (МеОН – однокислотное, Ме(ОН)2 – двухкислотное, Ме(ОН)3 – трехкислотное основание).
2.3.2.1. Классификация и номенклатура оснований.
Названия основаниям дают следующим образом: «гидроксид», затем русское название металла в родительном падеже, а в скобках римскими цифрами – степень окисления, если она переменная. Например: KOH –гидроксид калия, Ni(OH)2 – гидроксид никеля (II).
При обычных условиях основания – твердые вещества, кроме гидроксида аммония – водного раствора аммиака NH4OH (NH4+ – ион аммония, входящий в состав солей аммония).
В зависимости от отношения к воде основания делятся на растворимые (щелочи) и нерастворимые. К растворимым основаниям – щелочам относятся только гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, CsOH, RbOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2), а также водный раствор аммиака. Все остальные основания практически нерастворимы в воде.
Наличие в растворе щелочи определяют с помощью индикаторов: лакмуса (синий), фенолфталеина (малиновый), метилоранжа (желтый). Нерастворимые основания не меняют окраски индикаторов.
2.3.2.2. Получение оснований
1) Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
CuSO4 + 2KОН = Сu(ОН)2↓ + K2SO4,
K2СО3 + Ва(ОН)2 = 2KОН + ВаСО3↓.
При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль.
2) Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
2Li + 2Н2О = 2LiOH + H2↑,
SrO + H2O = Sr(OH)2.
3) Щелочи в технике обычно получают электролизом водных растворов хлоридов:

2.3.2.3. Химические свойства оснований
1) Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
NaOH + HNO3 = NaNO3 + H2O,
Cu(OH)2 + H2SO4 = СuSО4 + 2H2O.
2) Выше было показано, как щелочи взаимодействуют с кислотными и амфотерными оксидами.
3) При взаимодействии щелочей с растворимыми солями образуется новая соль и новое основание. Такая реакция идет до конца только в том случае, когда хотя бы одно из полученных веществ выпадает в осадок.
FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl.
4) При нагревании большинство оснований, за исключением гидроксидов щелочных металлов, разлагаются на соответствующий оксид и воду:
2Fе(ОН)3 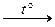 Fе2О3 + 3Н2О,
Fе2О3 + 3Н2О,
Са(ОН)2 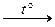 СаО + Н2О.
СаО + Н2О.
2.3.3. Кислоты –сложные вещества, молекулы которых состоят из одного или нескольких атомов водорода и кислотного остатка. Состав кислот может быть выражен общей формулой НхА, где А – кислотный остаток. Атомы водорода в кислотах способны замещаться или обмениваться на атомы металлов, при этом образуются соли.
2.3.3.1. Классификация и номенклатура кислот
Если кислота содержит один такой атом водорода, то это одноосновная кислота (HCl – соляная, HNO3 – азотная, HСlO – хлорноватистая, CH3COOH – уксусная); два атома водорода – двухосновные кислоты (H2SO4 – серная, H2S – сероводородная); три атома водорода – трехосновные (H3PO4 – ортофосфорная, H3AsO4 – ортомышьяковая).
В зависимости от состава кислотного остатка кислоты подразделяют на бескислородные (H2S, HBr, HI) и кислородсодержащие (H3PO4, H2SO3, H2CrO4). В молекулах кислородсодержащих кислот атомы водорода связаны через кислород с центральным атомом: Н–О–Э. Названия бескислородных кислот образуются из корня русского названия неметалла, соединительной гласной -о- и слова «водородная» (H2S – сероводородная). Названия кислородсодержащим кислотам дают так: если неметалл (реже металл), входящий в состав кислотного остатка, находится в высшей степени окисления, то к корню русского названия элемента добавляют суффиксы -н-, -ев-, или -ов- и далее окончание -ая- (H2SO4 – серная, H2CrO4 – хромовая). Если степень окисления центрального атома ниже, то используется суффикс -ист- (H2SO3 – сернистая). Если неметалл образует ряд кислот, используют и другие суффиксы (HClO – хлорноватистая, HClO2 – хлористая, HClO3 – хлорноватая, HClO4 – хлорная).
Кислоты измененяют окраску индикаторов в растворах кислот: лакмус (красный), метилоранж (розовый).
2.3.3.2. Получение кислот
1) Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом и последующим растворением соответствующих газов в воде:
H2 + Cl2 = 2HCl,
H2 + S = H2S.
2) Кислородсодержащие кислоты нередко могут быть получены при взаимодействии кислотных оксидов с водой.
3) Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
ВаВr2 + H2SO4 = ВаSО4↓+ 2HBr,
CuSO4 + H2S = H2SO4 + CuS↓,
FeS + H2SO4 (paзб.) = H2S↑ + FeSO4,
NaCl (тв.)+ Н2SO4 (конц.) = HCl↑ + NaHSO4,
AgNO3 + HCl = AgCl↓ + HNO3.
4) В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:
3Р + 5НNО3 + 2Н2О = 3Н3РO4 + 5NO↑.
2.3.3.3. Химические свойства кислот
1) Кислоты взаимодействуют с основаниями и амфотерными гидроксидами. При этом практически нерастворимые кислоты (H2SiO3, H3BO3) могут реагировать только с растворимыми щелочами.
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O.
2) Взаимодействие кислот с основными и амфотерными оксидами рассмотрено выше.
3) Взаимодействие кислот с солями – это обменная реакция с образованием соли и воды. Эта реакция идет до конца, если продуктом реакции является нерастворимое или летучее вещество, либо слабый электролит.
Ni2SiO3 + 2HCl = 2NaCl + H2SiO3↓,
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑.
4) Взаимодействие кислот с металлами – окислительно-восстановительный процесс. Восстановитель – металл, окислитель – ионы водорода у кислот-неокислителей (HCl, HBr, HI, H2SO4 (разб.), H3PO4) и анион кислотного остатка у кислот-окислителей (H2SO4 (конц.), HNO3 (конц. и разб.)). Продуктами реакции взаимодействия кислот-неокислителей с металлами, стоящими в ряду напряжений до водорода, являются соль и газообразный водород:
Zn + H2SO4 (разб.) = ZnSO4 + H2↑,
Zn + 2HCl = ZnCl2 + H2↑.
Кислоты окислители взаимодействуют почти со всеми металлами, включая и малоактивные (Cu, Hg, Ag), при этом образуются продукты восстановления аниона кислоты, соль и вода:
Сu + 2Н2SO4 (конц.) = CuSO4 + SO2↑ + 2Н2O,
Рb + 4НNО3 (конц.) = Pb(NO3)2 +2NO2↑ + 2Н2O.
2.3.4.Амфотерные гидоксидыпроявляют кислотно-основную двойственность: с кислотами они реагируют как основания:
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O,
а с основаниями – как кислоты:
Cr(OH)3 + NaOH = Na[Cr(OH)4]
(реакция протекает в растворе щелочи);
Сr(OH)3 + NaOH = NaCrO2 + 2H2O
(реакция протекает между твердыми веществами при сплавлении).
С сильными кислотами и основаниями амфотерные гидроксиды образуют соли.
Как и другие нерастворимые гидроксиды, амфотерные гидроксиды разлагаются при нагревании на оксид и воду:
Be(OH)2 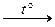 BeO + H2O.
BeO + H2O.
2.3.5.Соли – ионные соединения, состоящие из катионов металлов (или аммония) и анионов кислотных остатков.
2.3.5.1. Классификация и номенклатура солей
Любую соль можно рассматривать как продукт реакции нейтрализации основания кислотой. В зависимости от того, в каком соотношении взяты кислота и основание, получаются соли: средние (ZnSO4, MgCl2) – продукт полной нейтрализации основания кислотой, кислые (NaHCO3, KH2PO4) – при избытке кислоты, основные (CuOHCl, AlOHSO4) – при избытке основания.
Названия солей по международной номенклатуре образуют из двух слов: названия аниона кислоты в именительном падеже и катиона металла в родительном с указанием степени его окисления, если она переменная, римской цифрой в скобках. Например: Cr2(SO4)3 – сульфат хрома (III), AlCl3 – хлорид алюминия. Названия кислых солей образуют добавлением слова гидро- или дигидро- (в зависимости от числа атомов водорода в гидроанионе): Ca(HCO3)2 – гидрокарбонат кальция, NaH2PO4 – дигидрофосфат натрия. Названия основных солей образуют добавлением слова гидроксо- или дигидроксо-: (AlOH)Cl2 – гидроксохлорид алюминия, [Cr(OH)2]2SO4 – дигидроксосульфат хрома (III).
2.3.5.2. Химические свойства солей
1) Взаимодействие солей с металлами – окислительно-восстановительный процесс. При этом металл, стоящий левее в электрохимическом ряду напряжений, вытесняет последующие из растворов их солей:
Zn + CuSO4 = ZnSO4 + Cu.
Щелочные и щелочноземельные металлыне используют для восстановления других металлов из водных растворов их солей, поскольку они взаимодействуют с водой, вытесняя водород:
2Na + 2H2O = H2↑ + 2NaOH.
2) Взаимодействие солей с кислотами и щелочами было рассмотрено выше.
3) Взаимодействие солей между собой в растворе протекают необратимо лишь в том случае, если один из продуктов – малорастворимое вещество:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
4) Гидролиз солей – обменное разложение некоторых солей водой. Гидролиз солей будет подробно рассмотрен в теме «Электролитическая диссоциация».
2.3.5.3. Способы получения солей
В лабораторной практике обычно используют следующие способы получения солей, основанные на химических свойствах различных классов соединений и простых веществ:
1) Взаимодействие металлов с неметаллами:
Cu + Cl2 = CuCl2,
Fe + S = FeS.
2) Взаимодействие металлов с растворами солей:
Fe + CuCl2 = FeCl2 + Cu.
3) Взаимодействие металлов с кислотами:
Fe + 2HCl = FeCl2 + H2↑.
4) Взаимодействие кислот с основаниями и амфотерными гидроксидами:
3HCl + Al(OH)3 = AlCl3 + 3H2O.
5) Взаимодействие кислот с основными и амфотерными оксидами:
2HNO3 + CuO = Cu(NO3)2 + 2H2O.
6) Взаимодействие кислот с солями:
HCl + AgNO3 = AgCl↓ + HNO3.
7) Взаимодействие щелочей с солями в растворе:
3KOH + FeCl3 = Fe(OH)3↓ + 3KCl.
8) Взаимодействие двух солей в растворе:
NaCl + AgNO3 = NaNO3 + AgCl↓.
9) Взаимодействие щелочей с кислотными и амфотерными оксидами:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
10) Взаимодействие оксидов различного характера друг с другом:
CaO + CO2 = CaCO3.
Соли встречаются в природе в виде минералов и горных пород, в растворенном состоянии в воде океанов и морей.
Дата добавления: 2017-11-21; просмотров: 1599;











