Образование и свойства химической связи
Химическая связь образуется только в том случае, если при сближении атомов полная энергия системы понижается.
Химическая связь осуществляется при перекрывании облаков неспаренных электронов с антипараллельными спинами за счет электростатического взаимодействия ядер атомов с увеличившейся электронной плотностью между ними.
Рассмотрим для примера образование связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 4.1).
Рис. 4.1.Перекрывание электронных облаков при образовании молекулы водорода.
Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы (рис. 4.2). Однако при очень сильном сближении атомов резко возрастает отталкивание ядер. Оптимальное расстояние между ядрами – длина связи (lсв), при которой система имеет минимальную энергию. При переходе атомов в такое состояние выделяется энергия, называемая энергией связи (Есв).
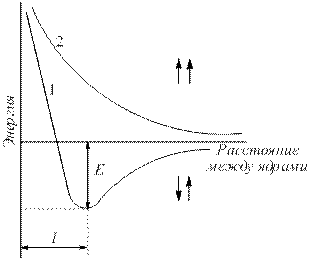
Рис. 4.2. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами (Е – энергия связи).
Если связь образована одинаковыми атомами, например Н–Н, Сl–Cl, NºN, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью.
Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон может служить электроотрицательность (ЭО). Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи.
В случае большой разности ЭО атомов, например, между s-металлами первой, второй групп периодической системы и неметаллами VI, VII групп (LiF, CsCl, K2O и др.) может иметь место не только смещение электронной плотности, но и полный переход электрона к более электроотрицательному атому с образованием положительного и отрицательного иона. Ионная химическая связьпредставляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении.
Таким образом, связи отличаются полярностью.
Полярность связи
Полярность связиобусловлена различной электроотрицательностью атомов, между которыми образуется химическая связь.
Вследствие смещения электронной пары связи к более электроотрицательному атому, он приобретает частичный (эффективный) отрицательный заряд (δ–). Второй атом приобретает частичный положительный заряд (δ+). Так возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии lд друг от друга (длина диполя). Мерой полярности связи служит электрический момент диполя (μсв), равный произведению эффективного заряда на длину диполя lд.
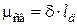 . .
| (4.1) |
Электрический момент диполя имеет единицу измерения кулон на метр (Кл×м). В качестве единицы измерения используют также внесистемную единицу измерения дебай – D, равную 3,3×10–30 Кл×м (табл. 4.1).
Как видно из табл. 4.1, электрический момент диполя растет с увеличением разности ЭО.
Таблица 4.1
Электрический момент диполя химической связи в молекулах
| Связь | Разность ЭО | μсв, D | Связь | Разность ЭО | μсв, D |
| Н–F | 1,9 | 1,98 | Н–О | 1,4 | 1,53 |
| Н–Сl | 0,9 | 1,03 | Н–N | 0,9 | 1,3 |
| Н–Br | 0,74 | 0,78 | Н–S | 0,4 | 0,7 |
| Н–I | 0,4 | 0,38 | Н–С | 0,4 | 0,3 |
Полярную ковалентную связь с δ, приближающейся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности. Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Полярность связи может меняться.
Не следует путать понятия полярность связи и полярность молекулы. Поскольку они совпадают только для двухатомных молекул. Для молекул, состоящих из большего числа атомов, дипольный момент является векторной суммой дипольных моментов всех связей. Дипольный момент может быть равен нулю, как у неполярных симметричных молекул (CO2, CCl4). Угловые и прамидальные молекулы – полярны, например, молекула воды, у которой центры тяжести положительных и отрицательного зарядов не совпадают.
Дата добавления: 2017-11-21; просмотров: 1855;











