Образование кратных связей
Кратные (двойные и тройные) связи образуются при наложении σ-, π-, и δ-связей. При наложении π-связи на σ-связь образуетсядвойная связь, например, в молекулах этилена, диоксида углерода.
Кратная связь изображается двумя черточками O=С=O; >C=C<.
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи (см. табл. 4.2).
При наложении двух π-связей на σ-связь возникает тройнаясвязь, например, в молекулах азота, ацетилена. Тройная связь изображается тремя черточками: N≡N, –С≡С–. Энергия тройной связи выше, а длина связи меньше, чем энергии и длины простой и двойной связей (см. табл. 4.2).
Число связей между атомами называется кратностью связи.
В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т.е. охватывающими не два атома, а часть или целые молекулы или ионы. Например, структура молекулы 1,3-бутадиена может быть записана в двух формах:
CH2=CH–CH=CH2 и –СH2–СН=СН–СН2–.
В действительности в чистом виде не существует ни той и ни другой структуры, а гибридная структура, в которой электроны π-связи принадлежат не двум конкретным атомам, а всей молекуле в целом. Пи-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями, обозначаемыми пунктиром:

Приведенная структура называется резонансной. Другими примерами соединений с делокализованными связями служат молекулы озона О3, бензола, а также ионы NO3–, CO32–, SO42–.
Механизмы образования ковалентных связей
Обменный механизм
Согласно обменному механизму метода валентных связей (ВС) каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности считают число неспаренных электронов у атома в основном или возбужденном состоянии атома.
Способность образовывать определенное число связей называется валентностью.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (или пар) электронов и перехода одного электрона (или нескольких электронов, равных числу разъединенных пар) на свободную орбиталь того же уровня. Например, валентная электронная конфигурация атома кальция в основном состоянии записывается как 4s2. При возбуждении его атома происходит распаривание электронов и один из s-электронов переходит на свободную p-орбиталь. Валентность кальция в возбужденном состоянии равна двум.
В отличие от элементов второго периода кислорода и фтора, электронные пары которых не могут разъединяться, так как все s- и p-орбитали на втором энергетическом уровне заняты и вакантных орбиталей нет, электронные пары атомов третьего периода серы и хлора могут распариваться в вакантные орбитали 3d-подуровня, соответственно сера, кроме валентности основного состояния 2, имеет еще валентности 4 и 6 в возбужденном состоянии, а хлор, кроме валентности 1 в основном состоянии, имеет валентности 3, 5 и 7 в возбужденном состоянии.
Обменный механизм не может объяснить образования химических связей в некоторых соединениях. Например, у иона аммония NH4+ атом азота образует четыре ковалентные связи с водородом:
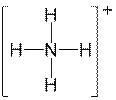 ,
,
хотя у атома азота всего три неспаренных электрона
| 2s | 2p | |||
| ↑↓ | ↑ | ↑ | ↑ |
Дата добавления: 2017-11-21; просмотров: 3352;











