Закон Бойля-Мариотта
При постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа:
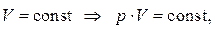
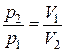 . .
| (1.15) |
Закон Гей-Люссака
При постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре (Т)
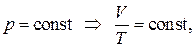
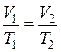 . .
| (1.16) |
Закон Шарля
При постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре
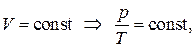
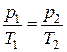
| (1.17) |
В результате объединения указанных законов, сделанного Б.Э.Клапейроном (1834 г.), было получено уравнение состояния идеального газа:
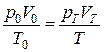 , ,
| (1.18) |
где pT и VT – давление и объем газа при данной температуре Т; p0 и V0 – давление и объем газа при нормальных условиях (0°С; 101,325 кПа).
Иначе можно записать это соотношение так:
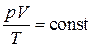 . .
| (1.19) |
Д.И. Менделеев ввел в уравнение универсальную газовую постоянную и количество молей (n):
| pV = nRT, | (1.20) |
Уравнение (1.13) - уравнение Клапейрона-Менделеева.
Универсальная газовая постоянная при нормальных условиях равна R = 8,314 Дж/моль·К. Физический смысл ее – работа расширения газа против сил внешнего давления при повышении температуры на 1 К.
Уравнение состояния идеального газа применимо и к смеси газов, при условии, что они не взаимодействуют между собой. В соответствии с законом Дальтона общее давление смеси газов равно сумме парциальных давлений всех входящих в нее газов:
| р = р1 + р2 + р3 +…+ рn, | (1.21) |
где р – общее давление смеси, р1, р2, р3, рn – парциальные давления компонентов смеси.
Глава 2. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Дата добавления: 2017-11-21; просмотров: 1237;











