Атомные и молекулярные массы
ОСНОВНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ И ЗАКОНЫ. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВ
Химия – наука о веществах и их превращениях
Вещество– вид материи, состоящий из дискретных частиц, обладающих массой покоя (атомы, молекулы, ионы). Способ существования материи – движение.
Фундаментальный закон природы – закон неуничтожимости материи и движения имеет следствием закон сохранения массы, открытый М.В. Ломоносовым в 1748 году и опубликованный в 1760 году: масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
Атомно-молекулярное учение
М.В. Ломоносов является также создателем атомно-молекулярного учения, которое он сформулировал в 1741 году.
Основные положения атомно-молекулярного учения:
1) Все вещества состоят из молекул, между которыми имеются промежутки. Молекула– мельчайшая частица вещества, обладающая его химическими свойствами.
2) Молекулы состоят из атомов, которые соединяются друг с другом в определенных соотношениях.
Атом – наименьшая частица химического элемента в составе простых и сложных веществ, химически неделимая.
3) Молекулы и атомы находятся в непрерывном движении.
4) Атомы характеризуются определенной массой и размерами.
5) Разным элементам соответствуют разные атомы (элемент – вид атомов).
6) Молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных – из разных.
Закон постоянства состава
Открытие закона сохранения массы ознаменовало переход химии к количественным методам исследования. Был изучен состав многих веществ и установлен закон постоянства состава в 1799-1807 гг. Ж. Прустом: всякое чистое вещество, независимо от способов его получения и нахождения в природе, имеет постоянный качественный и количественный состав.
Закон простых кратных отношений
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных весовых соотношениях. Многие элементы могут соединяться друг с другом в нескольких различных весовых соотношениях и при этом образуются разные вещества (СО, СО2). В молекулах СО и СО2, N2O, NO и NO2 состав меняется скачками, а не постепенно, что свидетельствует о дискретном строении вещества. Этот закон, подтвержденный на опыте, был первым доказательством реальности существования атомов.
Атомные и молекулярные массы
Атомы и молекулы имеют абсолютные массы порядка 10–24–10–21 г, неудобные для сравнения, поэтому химики пользуются относительными значениями масс атомов. Представление об относительной атомной массе было введено Дж. Дальтоном в 1803 г. За единицу массы он принял массу самого легкого атома – водорода. В настоящее время в качестве эталона принята масса 1/12 массы атома углерода изотопа 12С, равная 1,66043×10–24 г.
Относительная атомная (Аr) масса показывает во сколько раз данный атом тяжелее 1/12 массы атома изотопа углерода 12С.
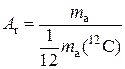 , ,
| (1.2) |
где mа – масса атома, mа(С) – масса атома изотопа углерода 12С.
Для определения атомной массы элементов в 19 веке использовался метод, основанный на законе теплоемкости П.Л. Дюлонга и А.Т. Пти (1819 г.): молярная теплоемкость (СМ) для различных простых веществ в кристаллическом состоянии одинакова и равна приблизительно 26,4 Дж. Она равна произведению удельной теплоемкости (Суд) на молярную массу элемента:
| Смолярная=Суд×М =26,4 Дж | (1.3) |
Используя величину удельной теплоемкости, которая легко определяется экспериментально (отношение количества теплоты полученного или отданного 1 г вещества к соответствующему изменению температуры) можно найти приближенное значение атомной массы. Исключения составляют легкие элементы, особенно неметаллы, имеющие теплоемкость значительно меньше (бериллий, бор, кремний, алмаз).
В настоящее время атомные массы элементов определяют методом масс-спектроскопии. Массы атомов определяют по отклонению траектории их ионов, двигающихся в магнитном поле, поскольку величина отклонение зависит от отношения массы иона к его заряду.
Относительная молекулярная масса (Mr)показывает во сколько раз данная молекула тяжелее 1/12 массы атома 12С.
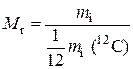 , ,
| (1.4) |
где mм – масса молекулы.
Дата добавления: 2017-11-21; просмотров: 2589;











