Опыт 2. Выделение дезоксирибонуклеопротеидов (ДРНП) из селезёнки и проведение качественных реакций на продукты их гидролиза
Дезоксирибонуклеопротеиды выделяют из тканей, богатых клеточными ядрами (зобная железа, селезенка, сперматозоиды и проч.). ДРНП растворяются в растворах солей средней концентрации, например, в хлориде натрия (1 М), с образованием вязких растворов и снова осаждаются при разведении последних (до 0,15М) в виде волокнистого нуклеопротеида.
Ход опыта.Выделение ДРНП из селезёнки.
В ступке растирают 5 г селезенки с равным количеством песка, добавляют вначале 5 мл охлажденного 2 М раствора хлорида натрия, а затем постепенно малыми порциями 25 мл охлажденного 1 М раствора хлорида натрия. Растирание продолжают 10-15 мин в ступке, охлаждаемой льдом. Образовавшуюся массу переносят в центрифужные пробирки и центрифугируют 15 мин. Измерив объем полученного центрифугата, вливают его в шестикратный объем воды тонкой струей, медленно размешивая жидкость деревянной палочкой. Выделившийся в виде нитей нуклеопротеид наматывается на деревянную палочку.
Если нити ДРНП не образовались, а выделился хлопьевидный осадок, то следует дать отстояться осадку, осторожно слить с него весь прозрачный отстой, а остаток жидкости подвергнуть центрифугированию. Осадок после центрифугирования исследуют на содержание в нем ДНК.
Реакция с дифениламином.
Дезоксирибонуклеиновую кислоту обнаруживают по ее реакции с дифениламином, который с дезоксирибозой дает синее окрашивание. Рибонуклеиновая кислота (или рибоза), в отличие от ДНК, дает с этим реактивом зелёное окрашивание.
В пробирку переносят немного осадка ДНК и растворяют его в 1-2 мл 0,4%-ного раствора гидроксида натрия. К раствору добавляют равный объем раствора дифениламина и смесь нагревают в кипящей водяной бане около 10-15 мин. Появляется синее окрашивание раствора. В другой пробирке нагревают с дифениламином раствор рибозы, к которому добавлено 1-2 мл 0,4%-ного раствора щелочи. Смесь окрашивается в зеленый цвет.
Реакция с фелинговой жидкостью.
Дезоксирибонуклеиновая кислота после мягкого кислотного гидролиза при взаимодействии с фелинговой жидкостью (нагревание до кипения) образуется осадок красно-кирпичного цвета. В результате кислотного гидролиза происходит распад гликозидных связей с пуриновыми основаниями. Образуется апуриновая ДНК с открытой формой дезоксирибозы, содержащей свободную альдегидную группу:
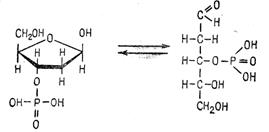
. Гликозидные связи рибозы, входящей в состав рибонуклеиновой кислоты, не подвергаются гидролизу в тех мягких условиях, в которых он идет у дезоксирибонуклеиновой кислоты.
В центрифужную пробирку берут небольшое количество де- зоксирибонуклеопротеида или дезоксирибонуклеиновой кислоты, добавляют 2 мл 1 н. раствора соляной кислоты, нагретой до 60°С, и пробирку ставят в водяную баню на 10 мин при 60°С. По охлаждении центрифугируют, сливают кислоту и к осадку прибавляют фуксинсернистую кислоту. Через некоторое время появляется фиолетовое окрашивание осадка.
Обнаружение углеводного компонента можно провести при помощи фелинговой жидкости (нагреть до кипения).
__________________________________________
Приготовление растворов:
-дифениламин – 1 г дифениламина растворяют в смеси 2,75 мл
концентрированной серной кислоты и 100 мл ледяной уксусной кислоты;
- фуксинсернистая кислота – 0,2 г фуксина растворяют в 200 мл дистиллированной воды и добавляют 2 г гидросульфита натрия NaHSO4 (или метабисульфит (пиросульфит) натрия Na2S2O5) и 2 мл концентрированной соляной кислоты. Через 15-20 мин. жидкость не обесцветится, то добавлют немного активированного угля, встряхивают смесь до обесцвечивания и затем фильтруют; реактив нестоек, поэтому его хранят в склянке из тёмного стекла;
- молибдат аммония – смешивают 15%-ный раствор молибдата аммония с концентрированной азотной кислотой в отношении 110:90;
- магнезиальная смесь – растворяют в воде 100 г хлорида магния, 200 г хлорида аммония, 20 мл конц. Раствора аммиака и разбавляют водой до 1 л.
Дата добавления: 2021-10-28; просмотров: 772;











