ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
18 в. А. Лавуазье даёт следующее определение кислотам: «кислоты – это соединения, которые содержат кислород»; имел в виду открытые тогда H2SO4, HNO3. Но более позднее открытие кислоты с формулой HCl поставило учёных в тупик.
19 в. С. Аррениус создаёт теорию электролитической диссоциации, в соответствии с которой:
а) кислоты – соединения, которые при диссоциации образуют ионы Н+;
б) основания – соединения, которые при диссоциации образуют ионы ОН-;
в) амфолиты – вещества, которые в водных растворах могут высвобождать как Н+, так и ОН-.
Но со временем возникли вопросы, на которые не могла ответить эта теория:
1) Как объяснить основные свойства NH3; R-NH2; 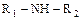 ;
; 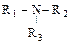 (ведь амины – это очень большой класс органических оснований).
(ведь амины – это очень большой класс органических оснований).
2) Как определить, кислотой или основанием будет полученное новое соединение?
Появились индикаторы.
20 в. Протолитическая теория И. Бренстеда и Т. Лоурипредлагает следующие определения:
Кислоты – доноры протонов (Н+):
кислота Û Н+ + основание.
Основания – акцепторы протонов:
основание + Н+ Û кислота.
Примеры:
1) 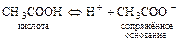 .
.
2) 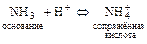 .
.
Т.е. по этой теории расширяется привычный круг кислот и оснований: ими также могут быть заряженные ионы.
Появились понятия «сопряжённая кислота» и «сопряжённое основание».
Природа воды
Н2О – амфолит по этой теории, т.к. может отдавать и присоединять протоны:
а) 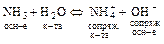 ;
;
б) 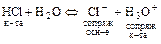 .
.
(Н3О+ - оксоний-ион).
При изучении поведения молекул чистой воды (например при выводе величины рН) можно записать Н2О Û Н+ + ОН-, а можно записать иначе:
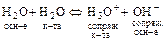 .
.
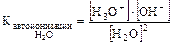 .
.
Экспериментально установили, что в чистой воде при температуре 25°С соблюдается равенство: 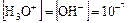 моль/л.
моль/л.
20 в. Г. Льюиспредлагает ещё одну теорию кислот и оснований.
Кислота – это акцептор электронной пары
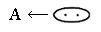
Основание – донор электронной пары
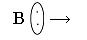
Реакция нейтрализации будет выглядеть:
А + В = АВ.
По этой теории:
1) расширяется круг привычных кислот; к ним также будут относиться ионы металлов (МеХ+); соединения бора (BCl3):
а) жёсткие кислоты(ж.к.) – это ионы щелочных, щелочно-земельных металлов и металлов с большим зарядом и маленьким радиусом (Li+, Ca2+, Al3+);
б) мягкие кислоты(м.к.) – тяжёлые ионы металлов с большим радиусом и малым зарядом (Cu+, Ag+, Hg2+).
2) Расширяется круг оснований; к ним относятся практически все лиганды и различные молекулы (NH3 или их производные):
а) жёсткие основания(ж.о.) – лиганды: F-, Cl-, Н2О, OH- и соединения R3N, NH3; поляризуются слабо;
б) мягкие основания (м.о.)– лиганды объёмные, хорошо поляризуются: S2-, HS-, RSH, SCN-, 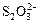 , CN-, J-.
, CN-, J-.
3) Наиболее прочные соединения образуются между:
а) жёсткими кислотами и жёсткими основаниями;
б) мягкими кислотами и мягкими основаниями.
Пример: 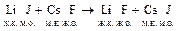 .
.
Становится понятно, почему реакция протекает в прямом направлении.
4) Однако эта теория имеет ограниченное применение, т.к. затруднена количественная оценка силы кислот и оснований. Если располагать основания по их силе в отношение одной кислоты, то получится один ряд, а если располагать эти же основания по отношению к другой кислоте, то получится другой ряд.
Дата добавления: 2017-10-04; просмотров: 1266;











