ОСНОВНЫЕ СВОЙСТВА S- МЕТАЛЛОВ.
ЩЕЛОЧНЫЕ – металлы 1 группы, главной подгруппы.
Электронное строение валентных орбиталей ns1. Называются так потому, что водные растворы их оксидов – сильные основания («щёлочи»):
Ме2О+ Н2О = 2МеОН.
Li, Na, K, Rb, Cs, Fr(радиоактивен), сверху вниз по подгруппе металлические свойства растут.
Физические свойства
Мягкие, лёгкие, серебристые, режутся ножом. Rb и Cs существуют в виде паст. Из-за высокой склонности к окислению их хранят под слоем керосина или вазелинового масла.
Химические свойства -
очень активны.
1. Реакции с простыми веществами
а) 4Na + O2 = 2Na2O оксид;
б) 2Na + Н2 = 2NаН гидрид;
в) 2Na + F2 = 2NaF фторид;
г) 6Na + N2 = 2Na3N нитрид;
д) 2Na + S = Na2S сульфид;
е) 3Na + Р= Na3Р фосфид;
ж) 4Na + Si= Na4Si силицид.
2. Реакции со сложными веществами:
а) 2Na + 2Н2О = 2NaОН + Н2;
б) 2Na + 2НСl = 2NaCl + Н2;
в) Реакции с Н2SO4 k и HNО3 идут по-разному (см. взаимодействие кислот со щелочно-земельными металлами).
Некоторые соединения Na и K
NаОН – едкий натр; каустическая сода;
NаНСО3 – питьевая сода;
Nа2СО3 – техническая (кальцинированная) сода;
К2СО3 – поташ.
ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ – металлы 2 группы
главной подгруппы.
Электронное строение валентных орбиталей ns2. Историческое название оксидов – «земли», при растворении в воде также получаются щёлочи, отсюда и название «щелочно-земельные»
МеО + Н2О = Ме(ОН)2.
земли щелочи
Не все металлы этой подгруппы обладают высокой активностью:
Ве – амфотерен; ВеО, Ве(ОН)2 – тоже амфолиты;
Mg – переходный металл; Mg(OH)2 – основание средней силы, малорастворимо; Са – щелочной металл; Са(ОН)2 – малорастворимое сильное основание ;
Sr – щелочной металл, Sr(OH)2 – растворимое сильное основание;
Ва – щелочной металл; Ва(ОН)2 – растворимое сильное основание;
Rа – радиоактивен.
Химические свойства
Для Са, Sr и Ва характерны те же химические реакции, что и для щелочных металлов. Следует особо выделить реакции очень активных металлов, Mg и Ве с Н2SO4 конц. и HNO3.
1. Щелочные и щелочно-земельные металлы восстанавливают S+6
в реакции с Н2SO4 конц. максимально;
Mg – в меньшей степени;
Ве реагирует с кислотой как малоактивный металл:
а) 8Na + 5H2SO4 = 4Na2SO4 + H2S + 4H2O;
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O;
б) 3Mg + 4H2SO4 = 3MgSO4 + S¯ + 4H2O;
в) Ве + 2H2SO4 = ВеSO4 + SO2 + 2H2O.
2. Реакции с HNO3 идут с большим количеством вариантов, при этом чем активнее металл и разбавленнее кислота, тем сильнее восстанавливается HNO3. Могут идти несколько параллельных реакций; может также идти одновременно реакция взаимодействие металла с водой, в которой растворена кислота.
а) 8Na + 9HNO3 разб. = 8NaNO3 + NH3 + 3H2O;
(или Ва) (или NH4NO3)
б) 8Na + 10HNO3 конц. = 8NaNO3 + N2О + 5H2O;
(или Ва)
в) 3Ве + 8HNO3 разб. = 3Ве(NO3)2 + 2NО + 4H2O;
г) Ве + 4HNO3 конц. = Ве(NO3)2 + NО2 + 2H2O.
Некоторые соединения кальция
1. Карбид Са легко разлагается водой:
СаС2 + 2Н2О = Са(ОН)2¯ + С2Н2.
2. Известняк, мел, мрамор: СаСО3
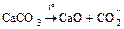 .
.
3. СаО – негашеная известь; реакция гашения:
СаО + Н2О ® Са(ОН)2.
4. Са(ОН)2 – гашеная известь;
Са(ОН)2, раствор – известковая вода;
Са(ОН)2, осадок – известковое молоко.
5. Реакция открытия СО2:
а) через известковую воду пропускают углекислый газ и выделяется осадок белого цвета:
Са(ОН)2 + СО2 = СаСО3¯ + Н2О;
б) при дальнейшем пропускании СО2 осадок растворяется, т.к. образуется растворимая кислая соль:
СаСО3¯ + СО2 + Н2О = Са(НСО3)2.
6. Жёсткость воды ( 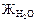 ) – совокупность свойств, обусловленная содержанием в воде ионов Са2+, Mg2+; её наличие приводит к ряду проблем:
) – совокупность свойств, обусловленная содержанием в воде ионов Са2+, Mg2+; её наличие приводит к ряду проблем:
а) на посуде и в паровых котлах образуется накипь;
б) стирка затруднена, т.к. плохо образуется пена;
в) пища утрачивает свой вкус.
Вопросы для закрепления материала:
1.Какой газ будет выделяться при взаимодействии перекиси водорода с перманганатом калия (в присутствии серной кислоты) – а)водород? б)кислород? в)двуокись серы?
2.Что получится при помещении металлического кальция в воду – а)мел? б)негашеная известь? в)известковое молоко?
Дата добавления: 2017-10-04; просмотров: 2185;











