Понижение давления насыщенных паров растворителя
Над любым растворителем в воздухе всегда находится какое-то количество газообразных молекул этого же растворителя. Чем выше температура, тем больше молекул растворителя в газообразном состоянии будет над раствором и соответственно давление паров растворителя (Р°) будет больше.
Если при этой же температуре измерить давление насыщенного пара растворителя уже над раствором какого-либо вещества (Р), то оно будет меньше. И всегда Р° > Р для любого растворителя.
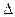 Р = (Р° - Р) – абсолютное понижение давления пара растворителя.
Р = (Р° - Р) – абсолютное понижение давления пара растворителя.
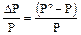 - относительное понижение давления пара растворителя.
- относительное понижение давления пара растворителя.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворённого вещества:
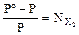 , где
, где 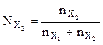 ;
;
n – число моль (х1 – растворитель; х2 – растворённое вещество).
Следствие 1: повышение температуры кипения раствора по сравнению с чистым растворителем прямопропорционально его моляльной концентрации (В).
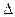 tкип = Е × В, где Е - эбулиоскопическая константа, величина табличная (различна у разных растворителей). Она показывает, на сколько градусов повысится температура кипения раствора с В = 1 моль/кг растворителя.
tкип = Е × В, где Е - эбулиоскопическая константа, величина табличная (различна у разных растворителей). Она показывает, на сколько градусов повысится температура кипения раствора с В = 1 моль/кг растворителя.
( 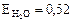 град/моль/кг Н2О).
град/моль/кг Н2О).
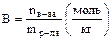 - моляльная концентрация.
- моляльная концентрация.
Следствие 2: понижение температуры замерзания раствора по сравнению с чистым растворителем прямопропорционально его моляльной концентрации:
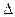 tзам = К × В, где К - криоскопическая константа, табличная величина
tзам = К × В, где К - криоскопическая константа, табличная величина
( 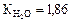 град/моль/кг Н2О).
град/моль/кг Н2О).
Пример: При какой температуре закипит 50%-ный раствор сахарозы в воде?
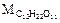 = 342 г/моль.
= 342 г/моль.
50% раствор: на 1000 г Н2О приходится 1000 г сахарозы;
в молях: 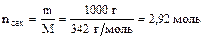 .
.
В = 2,92 моль/кг р-ля.
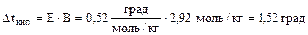 .
.
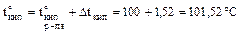 .
.
Ткип = 273 + 100 + 1,52 = 374,52 град К.
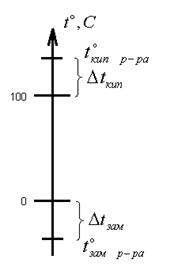
Для водных растворов изменение температур кипения и замерзания по сравнению с чистой Н2О можно отобразить так:
Вопросы для закрепления материала:
1.Чему равен изотонический коэффициент для AlC13 – 2, 3 или 4?
2.Почему варенье можно хранить зимой в стеклянных банках в неотапливаемом помещении?
Дата добавления: 2017-10-04; просмотров: 1337;











