Химические свойства
1. Н2О + Ме = основание (или оксид) + Н2
2К + 2Н2О = 2КОН + Н2;
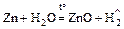 .
.
2. H2O + С1 2 = HCl + HСlO.
3. H2O + основной оксид = основание
H2O + СаО = Са(ОН)2.
4. H2O + кислотный оксид = кислота
H2O + SO3 = Н2SО4;
H2O + СО2 Û Н2СО3.
5. образует аквакомплексы
CuSО4 + 4H2O = [Cu(H2O)4] SО4.
6. разлагает многие бинарные соединения
К3N + 3Н2О = 3КОН + NН3;
Ca3P2 + 6Н2О = 3Ca(OH)2 + 2PН3;
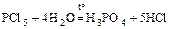 ;
;
LiH + Н2О = LiОН + Н2.
7. практически не диссоциирует
2Н2О Û Н3О+ + ОН- ( 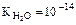 ).
).
8. разлагает некоторые соли (гидролиз идет до конца)
SbCl3 + H2O = SbOCl¯ + 2HCl.
9. перегретый водяной пар обладает особыми свойствами:
а) конверсия водяного газа
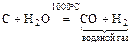 ;
;
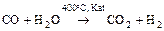 .
.
б) конверсия метана
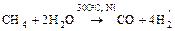 .
.
ВОДОРОД ПЕРОКСИД (перекись водорода; Н2О2)
Из-за несимметричного строения связей Н-О молекула сильно полярна, поэтому между молекулами Н2О2, как и между молекулами Н2О, существуют водородные связи и говорят не об единичных молекулах, а об ассоциатах (Н2О2)х.
Условно строение молекулы можно изобразить Н-О-О-Н; энергии связей различны: Есвязи О-О = 210 кДж/моль; Есвязи О-Н = 468 кДж/моль. Связь О-О более слабая и это сказывается на химических свойствах пероксида: Н2О2 хороший окислитель.
Благодаря возможности образования «кислородных мостиков» известны также надперекиси (ещё менее устойчивы, чем Н2О2): Н2О3 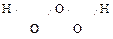 , Н2О4
, Н2О4 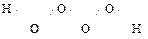 .
.
Дата добавления: 2017-10-04; просмотров: 1133;











