Соединения углерода
Соединения углерода с водородом (углеводороды) составляют основу органических соединений и рассматриваются в курсе органической химии.
Карбиды металлов стехиометрического состава можно рассматривать как производные углеводородов. Большинство из них относятся к ряду метанидов (производных метана) или ацетиленидов (производных ацетилена). Это солеподобные кристаллические вещества, гидролиз которых приводит к образованию соответствующего углеводорода:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
метан
CaC2 + 2H2O = Ca(OH)2 + C2H2
ацетилен
Карбиды переходных металлов - бертолиды, например, TiC, ZrC, Mo2C, Fe3C. Многие из них проявляют металлические свойства, имеют характерный металлический блеск, высокую тепло- и электропроводность. Большинство из них имеют высокую твердость, жаропрочность, тугоплавкость и коррозионную устойчивость.
Оксид углерода(II) - СО - бесцветный газ без вкуса и запаха, малорастворим в воде, чрезвычайно токсичен (угарный газ). Механизм токсичного действия угарного газа основан на необратимом связывании гемоглобина крови. Строение молекулы передается следующей схемой:

В промышленности оксид углерода(II) получают восстановлением оксида углерода(IV) раскаленным коксом:
t
CO2 + C = 2CO
Лабораторный метод получения СО основан на разложении муравьиной или щавелевой кислоты в присутствии концентрированной серной кислоты:
t
HCOOH ® CO + H2O
H2SO4
СО - несолеообразующий оксид, в обычных условиях не взаимодействует с водой, кислотами или щелочами. Однако в жестких условиях реагирует со щелочами, образуя соли муравьиной кислоты - формиаты:
t, p
NaOH + CO = HCOONa
Оксид углерода(II) - сильный восстановитель, легко окисляется кислородом и галогенами:
t t
2CO + O2 = 2CO2 ; CO + Cl2 = COCl2
t
CO + FeO = Fe + CO2
Непосредственно реагирует с никелем и железом, образуя карбонилы - координационные соединения, в которых СО выступает в роли лиганда.
60 °С t
Ni + 4CO = Ni(CO)4 ; Fe + 5CO = Fe(CO)5
тетракарбонил пентакарбонил
никеля железа
Цианистый водород – HCN - легкокипящая жидкость (т.кип. 27 °С) с характерным запахом горького миндаля. Сильнейший яд, смертельная доза около 50 мг. В промышленности получают взаимодействием оксида углерода(II) с аммиаком в автоклаве под давлением:
t
CO + NH3 = HCN + H2O
p
Cуществует в двух таутомерных формах с явной преобладанием первой из них:
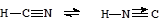
Цианистый водород неограниченно растворим в воде, в растворе ведет себя как слабая кислота (циановодородная или синильная кислота, К = 8×10-10). Соли - цианиды известны практически для всех металлов. Цианиды щелочных и щелочноземельных металлов хорошо растворимы и сильно гидролизованы, на воздухе медленно превращаются в карбонаты:
2KCN + CO2 + H2O = K2CO3 + 2HCN
Цианиды d-металлов в воде нерастворимы, но растворимы в растворах цианидов щелочных металлов:
Mn(CN)2¯ + 4KCN = K4[Mn(CN)6]
Цианиды очень сильные комплексообразующие реагенты, в присутствии окислителей растворяют серебро, золото и платину:
4Au + 8KCN + O2 + 2H2O = 4K[Au(CN)2] + 4KOH
Цианид-анион - сильный восстановитель:
2KCN + O2 = 2KCNO; KCN + S = KSNC
цианат калия тиоцианат калия
2Cu+2Cl2 + 4KCN = 2Cu+1CN + (CN)2 + 4KCl
дициан
Оксид углерода(IV) - CO2 - бесцветный газ, без вкуса и запаха. При давлении 6 атм переходит в жидкость, при быстром испарении которой образует кристаллическое вещество - сухой лед (сублимируется при -78 °С). Не поддерживает дыхание и горение, но вещества с большим сродством к кислороду горят в атмосфере диоксида углерода, например:
t
2Mg + CO2 = 2MgO + C
При повышенном давлении реагирует с водным раствором аммиака, образуя карбамид (мочевину):
t
CO2 + 2NH3 = OC(NH2)2 + H2O
p
Оксид углерода(IV) плохо растворим в воде, в которой ведет себя как слабая двухосновная кислота:
CO2 + H2O  CO2×H2O
CO2×H2O  H+ + HCO3-
H+ + HCO3-
В чистом виде угольная кислота не выделена и существует только в растворах, образуя два ряда солей.
CO2 + 2NaOH = Na2CO3; CO2 + NaOH = NaHCO3
карбонат натрия гидрокарбонат натрия
Карбонаты аммония и щелочных металлов (кроме лития) хорошо растворимы в воде и сильно гидролизованы:
CO32- + H2O  HCO3- + H+
HCO3- + H+
Карбонаты остальных металлов малорастворимы и термически нестойки:
t
CaCO3 = CaO + CO2
Карбонат кальция растворяется в воде в присутствии избытка СО2 с образованием гидрокарбоната:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Гидрокарбонаты в воде растворимы лучше, термически менее устойчивы, разрушаются уже при кипячении водного раствора:
t
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Карбонаты взаимодействуют с растворами сильных кислот с вытеснением угольной кислоты:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
22.2. Кремний и его соединения
Кремний второй по распространенности элемент земной коры (20 мол.%). Земная кора более чем наполовину состоит из кремнезема - SiO2, силикатных или алюмосиликатных пород. Кремнезем имеет несколько модификаций, в природе встречается в виде минерала кварца, кристаллическая модификация SiO2 - горный хрусталь. Окрашенные кристаллы горного хрусталя - аметист, топаз. Мелкокристаллические и аморфные образцы диоксида кремния - агат, яшма, халцедон, опал.
Кремний образует несколько аллотропных модификаций, наиболее устойчива из которых алмазоподобная.
Получают кремний восстановлением его диоксида или хлорида, а также разложением термически неустойчивых соединений:
t t
SiO2 + C = Si + CO2; SiCl4 + 2Zn = Si + 2ZnCl2:
t t
SiH4 = Si + 2H2; SiI4 = Si + 2I2
Химические свойства. В обычных условиях кремний очень устойчив и реагирует только со фтором:
Si + 2F2 = SiF4
При нагревании взаимодействует с другими неметаллами, исключая водород:
t t
Si + 2Cl2 = SiCl4; Si + O2 = SiO2
t t
3Si + 2N2 = Si3N4; Si + C = SiC
При высоких температурах кремний реагирует с активными металлами:
t
Si + 2Mg = Mg2Si
На кремний действует только смесь концентрированной азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
При нагревании кремний растворяется в водных растворах щелочей:
t
Si + 2KOH + H2O = K2SiO3 + 2H2
Соединения кремния
Степень окисления -4 для кремния нехарактерна и реализуется только в бинарных соединениях с активными металлами - силицидах. Силициды переходных металлов являются бертолидами, устойчивы к действию кислот и окислителей. Силициды непереходных металлов гидролитически неустойчивы, легко разлагаются водой и кислотами:
Mg2Si + 4HCl = 2MgCl2 + H4Si
Соединения кремния с водородом (силаны) нестойки, на воздухе самопроизвольно воспламеняются.
Из соединений кремния(II) известен только оксид - SiO, полученный взаимодействием кремния с его диоксидом при высоких температурах:
t
Si + SiO2 = 2SiO
Соединения кремния(IV) наиболее многочисленны. Их типичными представителями являются SiHal4, SiO2, SiS2, Si3N4, SiC.
Галогениды: SiF4 - газ, SiCl4 и SiBr4 - жидкости. Галогениды кремния очень реакционноспособны, легко гидролизуются.
SiCl4 + 3H20 = H2SiO3 + 4HCl
SiF4 + 2HF = H2SiF6
Гексафторкремниевая кислота - H2SiF6 - в чистом виде неустойчива, образует соли - гексафторсиликаты. Na2SiF6 применяется в качестве гербицида, при производстве стекол.
Диоксид кремния - SiO2 - кристаллическое вещество полимерного строения. Очень твердое и химически устойчивое, имеет низкий коэффициент температурного расширения, что позволяет использовать его для производства термостойкого стекла. Кварцевое стекло прозрачно для ультрафиолетового излучения и выдерживает большие перепады температур.
По химическим свойствам SiO2 кислотный оксид, но с водой не реагирует. Растворяется в растворах щелочей при нагревании:
t
SiO2 + 2KOH = K2SiO3 + H2O
Легко реагирует со фтором, фтороводородом и его водными растворами:
SiO2 + 2F2 = SiF4 + O2
SiO2 + 6HF = H2SiF6 + 2H2O
Кремний образует ряд кремниевых кислот, большинство из которых известно только по их солям - силикатам. В качестве индивидуальных веществ описаны ортокремниевая кислота - H4SiO4 и метакремниевая кислота - H2SiO3. Ортокремниевая кислота получается в виде водного раствора при гидролизе некоторых соединений кремния, например, его дисульфида:
SiS2 + 4H2O = H4SiO4 + 2H2S
Полученное вещество неустойчиво и при длительном хранении раствора полимеризуется.
Метакремниевая кислота образуется в виде золя или геля при действии сильных кислот на растворы силикатов:
Na2SiO3 + 2HCl = H2SiO3¯ + 2NaCl
Вещество нестойко, при хранении, а также при нагревании теряет воду, образуя в конечном итоге диоксид кремния.
H2SiO3 = SiO2 + H2O
H2SiO3 - слабая двухосновная кислота, образует соли - метасиликаты или просто силикаты. Силикаты щелочных металлов хорошо растворимы в воде, сильно гидролизованы.
SiO32- + H2O  HSiO3- + H+
HSiO3- + H+
Известно несколько типов полимерных силикатов - солей поликремниевых кислот, содержащих полимерные анионы, построенные из тетраэдров SiO44-. В природе широко распространены алюмосиликаты, содержащие также тетраэдры AlO45-, например, K2O×Al2O3×6SiO2 - ортоклаз (полевой шпат), Al2O3×6SiO2×2H2O - каолин.
Для силикатов характерно образование переохлажденных расплавов - стекол. Обычное оконное стекло получают сплавлением соды, песка и извести:
t
Na2CO3 + CaCO3 + 6SiO2 = Na2O×CaO×6SiO2 + 2СО2
Примеси оксидов других металлов придают стеклу окраску: оксиды железа - зеленую, оксиды марганца - коричневую. Изменяя состав сырья, получают специальные стекла: K2O×CaO×6SiO2 - тугоплавкое стекло, K2O×PbO×6SiO2 - хрусталь. Вызванная специальными добавками частичная кристаллизация силикатов приводит к образованию ситаллов - очень прочных стекол.
Как уже отмечалось, в отличие от углерода, кремний не образует устойчивых гомоцепей. Но чередование атомов кремния с атомами кислорода приводит к образованию очень устойчивых соединений - силоксанов мономерного и полимерного строения:
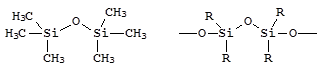
гексаметилдисилоксан силиконы
Полимерные силоксаны - силиконы - термостойки, устойчивы к окислению и гидрофобны. Некоторые силиконы растворяют до 20% кислорода, что позволяет использовать их в медицине при лечении легочных заболеваний.
22.3. Германий, олово, свинец
Германий, кларк которого составляет 2×10-4 мол.%, рассеянный элемент и самостоятельных руд практически не образует. Олово (кларк 7×10-4 мол.%) образует несколько минералов, важнейшими из которых являются: оловянный камень (касситерит) - SnO2 и станнит - SnS2×Cu2S×FeS. Важнейшие минералы свинца (кларк 1,6×10-4 мол.%): PbS - свинцовый блеск (галенит), PbSO4 - англезит, PbCO3 - церуссин.
Германий имеет одну, алмазоподобную модификацию - серовато-белые, очень хрупкие металлоподобные кристаллы, обладающие полупроводниковыми свойствами, т.пл. 959 °С. Олово образует две полимофные модификации. При температуре выше 13 °С устойчиво b-олово (плотность 7,3 г/см3, т.пл. 232 °С), при более низких температурах - a-олово (плотность 5,85 г/см3). Переход a-Sn ® b-Sn сопровождается увеличением объема на 25% и разрушением изделия ("оловянная чума"). Олово очень пластично, прокатывается в фольгу толщиной 0,0025 мм - станиоль. Свинец - темно-серый металл, на свежем срезе имеет голубоватый оттенок, который быстро тускнеет из-за окисления металла, т.пл. 327,5 °С, плотность 11,34 г/см3. Самый мягкий из тяжелых металлов, очень ковкий.
Свинец получают в промышленности восстановлением оксида свинца(II), германий и олово - восстановлением диоксидов (водородотермия):
t
GeO2 + 2H2 = Ge + 2H2O
Химические свойства. Германий, олово и свинец на воздухе и в воде довольно инертны. При нагревании взаимодействуют с большинством неметаллов (O2, S, F2, Cl2, Br2, P). Германий и олово образуют соединения в степени окисления +4, свинец - в степени окисления +2. Кислотами-окислителями германий и олово окисляются с образованием германиевой и оловянной кислот, которые представляют собой гидратированные малореакционноспособные оксиды.
Ge + HNO3(конц) ® GeO2×nH2O + NO2
Свежеполученная оловянная кислота растворяется в кислотах и щелочах.
+ HCl + NaOH
H2[SnCl6] ¾ SnO2×nH2O ¾® Na2[Sn(OH)6]
При растворении в разбавленной азотной кислоте олово образует нитрат олова(II).
3Sn + 8HNO3(разб) = 3Sn(NO3)2 + 2NO + 4H2O
Свинец растворяется в кислотах с образованием солей свинца(II), серной и соляной кислотами на холоду пассивируется за счет образования пленки нерастворимых солей.
При нагревании олово и свинец растворяются в водных растворах щелочей:
t
Pb + 2KOH + 2H2O = K2[Pb(OH)4] + H2
Германий взаимодействует со щелочами только в присутствии окислителей:
t
Ge + 2KOH + 2H2O2 = K2[Ge(OH)6]
Гидриды германия и олова крайне неустойчивы. О существовании гидрида свинца можно судить только по косвенным признакам.
Соединения в степени окисления +2 для германия нехарактерны. Олово и свинец образуют галогениды. Свинец образует также соли, из которых хорошо растворимы в воде нитрат и ацетат.
Оксиды и гидроксиды Ge(II), Sn(II) и Pb(II) в воде нерастворимы и амфотерны. При этом у соединений германия преобладают кислотные свойства, а у соединений свинца - основные. Соединения германия(II) и олова(II) - сильные восстановители.
Соединения в степени окисления +4 устойчивы для германия и олова и малохарактерны для свинца. Диоксид германия кислотный, диоксиды олова и свинца амфотерны, химически малоактивны. Соединения свинца(IV) сильные окислители.
Германий, олово и свинец образуют разнообразные металлоорганические соединения, отличающиеся высокой физиологической активностью. Органические соединения олова применяют в качестве пестицидов, чтобы снизить обрастание моллюсками корпусов морских кораблей. Тетраэтилсвинец - Pb(C2H5)4 - используется как добавка, повышающая октановое число бензина (устойчивость к детонации). Органические соединения, а также растворимые неорганические соединения олова и особенно свинца ядовиты.
Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409
Дата добавления: 2017-10-04; просмотров: 3355;











