Лекция № 20. Элементы VIA-подгруппы
В главную подгруппу VI группы (подгруппу VIA) входят следующие элементы: кислород - О, сера - S, селен - Se, теллур - Te и полоний - Po. Общая электронная формула их атомов - ns2np4. Отсутствие энергетически доступных d-орбиталей и высокая электроотрицательность атома кислорода обусловливает его отличия от остальных элементов подгруппы. Для него характерна степень окисления -2; соединения в других степенях окисления представлены единичными примерами: 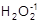 ,
, 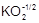 , O2+1F2, O2+F2. Для серы и элементов подгруппы селена наряду со степенью окисления -2 возможны положительные степени окисления, в основном +4 и +6. Увеличение эффективного радиуса атома при переходе от серы к полонию сопровождается уменьшением электроотрицательности элемента и усилением металлического характера простых веществ.
, O2+1F2, O2+F2. Для серы и элементов подгруппы селена наряду со степенью окисления -2 возможны положительные степени окисления, в основном +4 и +6. Увеличение эффективного радиуса атома при переходе от серы к полонию сопровождается уменьшением электроотрицательности элемента и усилением металлического характера простых веществ.
20.1. Кислород и его соединения
Кислород - самый распространенный элемент земной коры (58 мол.%). В природе представлен тремя изотопами: 16O, 17O (0,04%), 18O(0,2%). В виде простого вещества входит в состав атмосферы (20,9 об.% или 23,2 мас. %). Значительная часть элемента кислород входит в состав воды гидросферы, многих руд и минералов (оксиды, сульфаты, карбонаты, силикаты и т.д.).
Элемент кислород образует два простых вещества, аллотропные модификации, отличающиеся составом молекул - кислород (О2) и озон (О3). Вещество кислород представляет собой бесцветный газ без вкуса и запаха. При температуре -183 °С кислород сжижается, образуя подвижную жидкость голубого цвета, которая кристаллизуется при - 219 ° с образованием кристаллов синего цвета. Играет важную биологическую роль, обеспечивая процессы дыхания.
Озон образован трехатомными молекулами, строение которых можно представить следующей схемой:
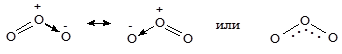
Несмотря на то, что озон - простое вещество, часто его рассматривают как соединение кислорода в степени окисления +4 - O4+O2-2. Озон - газ синего цвета с резким раздражающим запахом, т.кип. -112 °С, очень токсичен - предельная допустимая концентрация в воздухе (ПДК) 0,16 мг/м3. В малых концентрациях озон обладает обеззараживающим действием. В природе образуется при грозовых разрядах и в верхних слоях атмосферы при действии на молекулярный кислород жесткого ультрафиолетового облучения:
hn
3О2 = 2О3
Основное количество озона, образующегося в природных условиях, расположено в верхних слоях атмосферы на высоте 20-30 км, образуя так называемый "озоновый экран". В приземных слоях атмосферы содержание озона составляет 10-7-10-6%. Содержание озона в озоновом экране таково, что при атмосферном давлении он образовал бы слой газа толщиной около 1 см. Несмотря на малую концентрацию, озон играет очень важную биологическую роль, задерживая губительное для всех форм жизни жесткое ультрафиолетовое излучение. В последние годы возникла угроза целостности озонового экрана, разрушаемого при попадании в верхние слои атмосферы фреонов, которые широко применяются в качестве хладагентов в бытовых холодильниках и аэрозольных упаковках.
Получение. В промышленности кислород получают фракционной перегонкой (ректификацией) жидкого воздуха. Лабораторные методы получения кислорода основаны на термическом разложение веществ, богатых кислородом - KMnO4, KClO3, H2O2 и т.п.
t
2KMnO4 ¾® K2MnO4 + MnO2 + O2
t
2KClO3 ¾® 2KCl + 3O2
В лабораторных условиях озон получают при действии на кислород слабого (тлеющего) электрического разряда. При этом образуется смесь, содержащая 20-30% озона - озонированный кислород.
Химические свойства. По химическим свойствам кислород один из наиболее активных неметаллов, реагирующий с большинством простых веществ. Соответствующие реакции будут рассмотрены при изучении химии других элементов и их соединений. Непосредственно с кислородом не взаимодействуют только инертные газы, галогены и благородные металлы (серебро, золото и платина).
Озон по химическим свойствам напоминает кислород, однако отличается большей активностью. Например, озон при обычных условиях окисляет малоактивные металлы:
8Ag + 2O3 = 4Ag2O + O2
Качественной реакцией на озон является посинение бумаги, смоченной иодидом калия и крахмалом (иодокрахмальная бумага), за счет образования иода при окислении KI.
2KI + O3 + H2O = I2 + 2KOH + O2
Применяется озон для дезинфекции воздуха и воды, а также как эффективный окислитель в химическом синтезе.
20.2. Сера и ее соединения
Сера представлена в природе четырьмя изотопами: 32S (95%), 33S, 34S и 36S. Кларк серы составляет 0,03 мол.%. Значительное количество серы находится в виде простого вещества (самородная сера). Однако бóльшая часть серы входит в состав минералов, как сульфидных, так и сульфатных: ZnS - цинковая обманка, сфалерит; PbS - свинцовый блеск, галенит; Cu2S - медный блеск; HgS - киноварь; FeS2 - железный колчедан или пирит; CuFeS2 - халькопирит; Na2SO4×10H2O - глауберова соль или мирабилит; CaSO4×2H2O - гипс.
Элемент сера образует несколько аллотропных модификаций. Наиболее устойчива ромбическая сера (a-сера), представляющая собой желтые хрупкие кристаллы, нерастворимые в воде, но растворимые в некоторых органических растворителях (сероуглерод, толуол). При температуре выше 96 °С устойчива моноклинная сера (b-сера). Обе модификации имеют молекулярное строение и построены из циклических молекул S8 , по-разному упакованных в кристалле, т.е. фактически представляют собой полиморфные модификации.
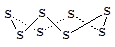
При нагревании кристаллической серы до 113 °С она плавится, образуя темную подвижную жидкость, которая при дальнейшем нагревании вначале густеет, а затем снова размягчается и при температуре 445 °С закипает. В парах сера, в зависимости от температуры, образует молекулы разного состава:
>1500 °C
S8 ¾® S6 ¾® S4 ¾® S2 ¾® S
При выливании кипящей серы в воду образуется пластическая сера, представляющая собой тягучую массу, напоминающая сырой каучук, образованная полимерными зигзагообразными цепями
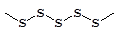
Пластическая сера неустойчива и со временем переходит в ромбическую серу.
Чистая сера не ядовита. Прием внутрь небольших ее количеств способствует заживлению ран и нарывов. Серный порошок входит в состав мазей для лечения кожных заболеваний.
Строение атома серы - 1s22s22p63s23p43d0 - обуславливает проявление этим элементом степени окисления - 2 при взаимодействии с элементами меньшей электроотрицательности. Образуя связи с элементами большей электроотрицательности (F, O, N, Cl), сера проявляет высшие валентности и положительные степени окисления (в основном +4 и +6) за счет переноса части валентных электронов на вакантные d-орбитали:
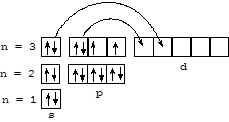
Химические свойства. Сера - активный неметалл, легко взаимодействующий с активными металлами и неметаллами. В парах серы горит водород:
t
H2 + S  H2S
H2S
При нагревании сера окисляет углерод и кремний:
t t
С + 2S = CS2; Si + 2S = SiS2
В качестве окислителя сера выступает также при взаимодействии с металлами. Большинство реакций данного типа требует нагревания, при комнатной температуре с серой реагирует только ртуть.
t
Zn + S = ZnS; Hg + S = HgS
Использование избытка серы приводит к образованию полисульфидов, простейшим представителем которых является дисульфид железа(II), образующий минерал пирит:
Fe + 2S = FeS2
При взаимодействии с галогенами и кислородом сера выступает в качестве восстановителя. Фтор обычно окисляет серу до высшей степени окисления с образованием SF6. Взаимодействие серы с хлором идет ступенчато:
t t
2S + Cl2 = S2Cl2; S2Cl2 + Cl2 = 2SCl2
Горение серы на воздухе и в атмосфере кислорода приводит к образованию оксида серы(IV):
t
S + O2 = SO2
При кипячении с кислотами-окислителями (азотная и концентрированная серная кислота) сера также окисляется:
t
S + 4HNO3(конц) = SO2 + 4NO2 + 2H2O
При нагревании с водными растворами щелочей сера диспропорционирует:
3S + 6KOH = 2K2S + K2SO3 + 3H2O
Соединения серы
Наиболее важными соединениями серыв степени окисления -2 являются сероводород и сульфиды.
Сероводород - H2S - бесцветный газ с характерным запахом гниющего белка, токсичен. Образуется при непосредственном взаимодействии водорода с парами серы. В лаборатории сероводород получают действием сильных кислот на сульфиды металлов:
Na2S + 2HCl = 2NaCl + H2S
Сероводород сильный восстановитель, окисляется даже оксидом серы(IV).
2H2S-2 + S+4O2 = 3S0 + 2H2O
На воздухе и в атмосфере кислорода сероводород горит, образуя серу или SO2 в зависимости от условий.
В воде сероводород малорастворим (2,5 объема H2S на 1 объем воды) и ведет себя как слабая двухосновная кислота.
H2S  H+ + HS-; К1 = 1×10-7
H+ + HS-; К1 = 1×10-7
HS-  H+ + S2-; К2 = 2,5×10-13
H+ + S2-; К2 = 2,5×10-13
Как двухосновная кислота сероводород образует два ряда солей: гидросульфиды (кислые соли) и сульфиды (средние соли). Например, NaНS - гидросульфид и Na2S - сульфид натрия.
Сульфиды большинства металлов в воде малорастворимы, окрашены в характерные цвета и отличаются по растворимости в кислотах: ZnS - белый, CdS - желто-оранжевый, MnS - телесного цвета, HgS, CuS, PbS, FeS - черные, SnS - бурый, SnS2 - желтый. В воде хорошо растворимы сульфиды щелочных и щелочноземельных металлов, а также сульфид аммония. Растворимые сульфиды сильно гидролизованы.
Na2S + H2О  NaHS + NaOH
NaHS + NaOH
При нагревании растворы сульфидов растворяют серу с образованием полисульфидов
Na2S + (n-1)S = Na2Sn
При действии на растворы полисульфидов минеральных кислот выделены полисульфаны - нестойкие маслоподобные вещества состава H2Sn , где n изменяется от 2 до 23.
Основные соединения серыв степени окисления +4:
SF4 SOCl2 SO2 [SO3]2-
фторид серы(IV) оксохлорид серы(IV) оксид серы(IV) сульфит- анион
Фторид серы(IV) - бесцветный газ. Оксохлорид серы(IV) (хлористый тионил, тионилхлорид) - бесцветная жидкость с резким запахом. Эти вещества широко применяются в органическом синтезе для получения фтор- и хлорорганических соединений.
Наибольшее значение имеет оксид серы(IV) - бесцветный газ с резким неприятным запахом горящей серы. Молекула SO2 имеет угловое строение (угол OSO равен 119,5 °):

В промышленности SO2 получают обжигом пирита или сжиганием серы. Лабораторный метод получения диоксида серы - действие сильных минеральных кислот на сульфиты.
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
SO2 является энергичным восстановителем,
S+4O2 + Cl2 = S+6O2Cl2
но, взаимодействуя с сильными восстановителями, может выступать в роли окислителя:
2H2S + S+4O2 = 3S0 + 2H2O
Диоксид серы хорошо растворим в воде (40 объемов на 1 объем воды). В водном растворе гидратированные молекулы SO2 частично диссоциируют с образованием катиона водорода:
SO2×H2O  H+ + HSO3-
H+ + HSO3-  2H+ + SO32-
2H+ + SO32-
По этой причине водный раствор диоксида серы часто рассматривают как раствор сернистой кислоты - H2SO3, хотя реально это соединение, по-видимому, не существует. Тем не менее, соли сернистой кислоты устойчивы и могут быть выделены в индивидуальном виде:
SO2 + NaOH = NaHSO3; SO2 + 2NaOH = Na2SO3
гидросульфит натрия сульфит натрия
Сульфиты щелочных металлов хорошо растворимы в воде, в значительной мере гидролизованы:
SO32- + H2О  HSO3- + ОН-
HSO3- + ОН-
Сильные восстановители, при нагревании диспропорционируют:
t
4Na2S+4O3 = Na2S-2 + 3Na2S+6O4
Соединений серыв степени окисления +6:
SF6 SO2Cl2 SO3 H2SO4 [SO4]2-
фторид серы(VI) диоксодихлорид серы(VI) оксид серы(VI) серная кислота сульфат-анион
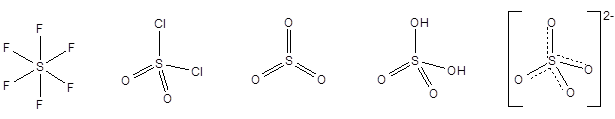
SF6 - бесцветный очень инертный газ, применяется в качестве газообразного диэлектрика. SO2Cl2 (хлористый сульфурил, сульфурилхлорид) - бесцветная жидкость, дымящаяся на воздухе вследствие гидролиза, применяется в органическом синтезе как хлорирующий реагент.
Оксид серы(VI) - бесцветная жидкость (т.кип. 44,8 °С, т.пл. 16,8 °С). В газообразном состоянии SO3 имеет мономерное строение, в жидком - преимущественно существует в виде циклических тримерных молекул, в твердом состоянии - полимер.
В промышленности триоксид серы получают каталитическим окислением ее диоксида.
t
2SO2 + O2 ¾® 2SO3
V2O5
В лаборатории SO3 можно получить перегонкой олеума - раствора триоксида серы в серной кислоте.
SO3 - типичный кислотный оксид, энергично присоединяющий воду и другие протонсодержащие реагенты:
SO3 + H2O = H2SO4; SO3 + HF = HOSO2F
фторсерная (фторсульфоновая)
кислота
Серная кислота - H2SO4 - бесцветная маслянистая жидкость, т.пл. 10,4 °С, т.кип. 340 °С (с разложением). Неограниченно растворима в воде, сильная двухосновная кислота. Концентрированная серная кислота - энергичный окислитель, особенно при нагревании. Она окисляет неметаллы и металлы, стоящие в ряду стандартных электродных потенциалов правее водорода:
t
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
t
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Взаимодействуя с более активными металлами, серная кислота может восстанавливаться до серы или сероводорода, например,
4Zn + 5H2SO4 (конц.) = 4ZnSO4 + H2S + 4H2O
Холодная концентрированная серная кислота пассивирует многие металлы (железо, свинец, алюминий, хром) за счет образования на их поверхности плотной оксидной или солевой пленки.
Серная кислота образует два ряда солей, содержащие сульфат-анион - SO42- (средние соли) или гидросульфат-анион - HSO4- (кислые соли). Сульфаты в основном хорошо растворимы в воде, плохорастворимы BaSO4, SrSO4, PbSO4, Cu2SO4. Образование белого мелкокристаллического осадка сульфата бария при действии на раствор хлорида бария является качественной реакцией на сульфат-анион. Эта реакция применяется и для количественного определения серы.
Важнейшими солями серной кислоты является: Na2SO4×10H2O - мирабилит, глауберова соль - применяется при производстве соды и стекла; MgSO4×7H2O - горькая английская соль - применяется в медицине как слабительное, для отделки тканей, при дублении кожи; CaSO4×2H2O - гипс - применяется в медицине и строительстве; CaSO4×1/2H2O - алебастр - применяется как строительный материал; CuSO4×5H2O - медный купорос - используется в сельском хозяйстве для защиты растений от грибковых заболеваний; FeSO4×7H2O - железный купорос - применяется в сельском хозяйстве в качестве микроудобрения и при очистке воды в качестве коагулятора; K2SO4×Al2(SO4)3×24H2O - алюмокалиевые квасцы - применяются для дубления кож.
Синтез серной кислоты в промышленности осуществляется контактным методом, первой стадией которого является обжиг пирита:
t
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее оксид серы(IV) окисляют при 450 °С кислородом до оксида серы(VI) в контактном аппарате на катализаторе (V2O5):
t
2SO2 + O2 = 2SO3
Оксид серы(VI) растворяют в концентрированной серной кислоте с образованием олеума, разбавлением которого получают серную кислоту необходимой концентрации.
Пиросерная (двусерная) кислота - H2S2O7
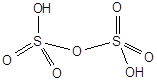
Бесцветные легкоплавкие кристаллы, выделяющиеся из олеума.
SO3 + H2SO4 = H2S2O7
Соли пиросерной кислоты - пиросульфаты (дисульфаты) - получают термическим разложением гидросульфатов:
t
KHSO4 = K2S2O7 + H2O
Тиосерная кислота - H2S2O3
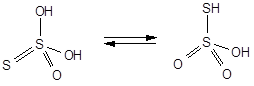
В водных растворах неустойчива и распадается с выделением серы и SO2
H2S2O3 = S¯ + SO2 + H2O
Соли тиосерной кислоты - тиосульфаты - устойчивы и могут быть получены кипячением серы с водными растворами сульфитов:
Na2SO3 + S = Na2S2O3
Тиосульфаты являются сильными восстановителями, тиосульфат натрия широко применяется в фотоделе как закрепитель и в аналитической химии для количественного определения иода и веществ, выделяющих иод (иодометрический анализ).
Политионовые кислоты - H2SxO6 (x = 2 - 6)
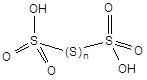
Политионовые кислоты неустойчивы, но образуют устойчивые соли - политионаты. Тетратионат натрия образуется при действии иода на водный раствор тиосульфата натрия:
Na2S2O3 + I2 = Na2S4O6 + 2NaI
Пероксосерные (надсерные) кислоты.
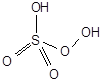
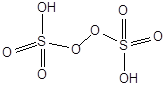
H2SO5 - мононадсерная кислота H2S2O8 - пероксодисерная кислота
(кислота Каро)
Пероксодисерная кислота получается при электролизе водного раствора серной кислоты:
2HSO4- - 2e- = H2S2O8
Образует соли - персульфаты. Персульфат аммония - (NH4)2S2O8 - применяется в лабораторных условиях как окислитель.
20.3. Селен, теллур и их соединения
Селен и теллур - редкие элементы. Кларк селена - 1,5×10-4 мол.%, теллура - 1,3×10-7 мол.%. Самостоятельных минералов практически не имеют, сопутствуют сере в сульфидных минералах. Образуют несколько аллотропных модификаций, полупроводники.
По химической активности уступают сере. При нагревании легко окисляются кислородом, галогенами, азотной кислотой. Теллур при нагревании окисляется водой:
160 °C
Te + 2H2O ¾® TeO2 + 2H2
При кипячении с водными растворами щелочей селен и теллур диспропорционируют:
3Se + 6NaOH = 2Na2Se + Na2SeO3 + 3H2O
селенид и селенит натрия
При взаимодействии с активными металлами селен и теллур выступают в роли окислителя:
Se0 + 2Na = Na2Se-2
H2Se и H2Te - бесцветные газы с отвратительным запахом, растворимые в воде. В водных растворах ведут себя как двухосновные кислоты, несколько более сильные, чем сероводородная кислота. Образуют соли - селениды и теллуриды. Теллуро- и селеноводород, а также их соли чрезвычайно ядовиты.
Оксиды селена(IV) и теллура(IV) образуются при окислении простых веществ кислородом и являются твердыми полимерными соединениями. Типичные кислотные оксиды. Оксид селена(IV) растворяется в воде, образуя селенистую кислоту:
SeO2 + H2O = H2SeO3
Оксид теллура(IV) в воде нерастворим, но взаимодействует с водными растворами щелочей, образуя теллуриты:
TeO2 + 2NaOH = Na2TeO3
SeO2 и TeO2 - более сильные окислители по сравнению с SO2.
2SO2 + SeO2 = Se + 2SO3
Оксиды селена(VI) и теллура(VI) - типичные кислотные оксиды. SeO3 растворяется в воде образуя селеновую кислоту - H2SeO4. Селеновая кислота представляет собой белое кристаллическое вещество, сильная кислота, обугливает органические соединения, сильный окислитель. Селенаты бария и свинца нерастворимы в воде.
TeO3 в воде практически нерастворим, но взаимодействует с водными растворами щелочей, образуя соли теллуровой кислоты - теллураты.
TeO3 + 2NaOH = Na2TeO4 + H2O
При действии на растворы теллуратов соляной кислоты выделяется ортотеллуровая кислота - H6TeO6, обезвоживанием которой можно получить теллуровую кислоту.
Na2TeO4 + 2HCl + 2H2O = H6TeO6 + 2NaCl
t
H6TeO6 ¾® H2TeO4 + 2H2O
Соединения селена токсичны для растений и животных. Соединения теллура значительно менее ядовиты. Отравление соединениями селена и теллура сопровождается появлением у пострадавшего устойчивого отвратительного запаха.
Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328
Дата добавления: 2017-10-04; просмотров: 1758;











