Лекция № 21. Элементы VA-подгруппы
Главная подгруппа V группы (подгруппа VA) включает азот - N, фосфор - P, мышьяк - As, сурьму - Sb и висмут - Bi, объединенные общей электронной формулой - ns2np3. В своих соединениях азот и фосфор проявляют все возможные степени окисления от -3 до +5 (наиболее характерны -3, +3 и +5). Однако отсутствие энергетически доступных d-орбиталей не позволяет азоту проявлять валентность выше 4, в то время как фосфор способен проявляет валентность 5 и даже 6 за счет привлечения орбиталей 3d-подуровня.
При увеличении порядкового номера в пределах VА-подгруппы усиливаются металлические признаки химических элементов (мышьяк и сурьма - полупроводники, висмут - металл) и уменьшается устойчивость соединений в высшей степени окисления.
21.1. Азот и его соединения
Азот - распространенный элемент земной коры (0,03 мол.%), представлен в природе двумя изотопами - 14N (99,6%) и 15N. Основная масса азота входит в состав атмосферы (78% по объему). Кроме этого азот образует несколько минералов, основными из которых являются: чилийская селитра - NaNO3 и индийская селитра - KNO3. Азот входит в состав живых организмов в основном в виде аминокислот, полипептидов, белков и азотистых оснований.
Образует простое вещество, состоящее из двухатомных молекул N2. Азот - бесцветный газ, без вкуса и запаха, не поддерживающий жизнедеятельность. Очень плохо растворим в воде, но под давлением растворимость азота в воде и биологических жидкостях сильно увеличивается. Растворенный под давлением азот оказывает наркотическое действие и вызывает глубоководное опьянение у водолазов. Быстрое выделение азота из крови при уменьшении давления вызывает кессонную болезнь. При охлаждении до -196 °С (77 К) азот сжижается, образуя бесцветную подвижную жидкость, кристаллизующуюся при - 210 °С. В кристаллическом состоянии существует в двух полиморфных модификациях.
В промышленности азот получают фракционной перегонкой жидкого воздуха. Лабораторный метод получения азота основан на термическом разложении нитрита аммония:
t
NH4NO2 ¾® N2 + 2H2O
Химические свойства. По электроотрицательности азот уступает только фтору и кислороду, однако чрезвычайная устойчивость молекулы N2 обуславливает высокую химическую инертность азота. При комнатной температуре с азотом реагирует только литий:
6Li + N2 = 2Li3N
нитрид лития
При сильном нагревании азот реагирует с другими щелочными и щелочноземельными металлами, бором и алюминием.
t
N2 + 2Al = AlN
При повышенных температурах азот реагирует с водородом и кислородом:
t, p 3000-4000 °C
N2 + 3H2  2NH3; N2 + O2
2NH3; N2 + O2  2NO
2NO
Соединения азота
Соединения азота в степени окисления -3 представлены аммиаком и нитридами металлов.
Аммиак - NH3 - бесцветный газ с характерным резким запахом. Молекула аммиака имеет пирамидальное строение и содержит неподеленную пару электронов на атоме азота:

При температуре -33,4 °С аммиак конденсируется, образуя жидкость с очень высокой теплотой испарения, что позволяет использовать его в качестве хладагента в промышленных холодильных установках. Жидкий аммиак хороший растворитель, в нем растворяются щелочные и щелочноземельные металлы, образуя окрашенные токопроводящие растворы. В присутствии катализатора (FeCl3) растворенный металл реагирует с аммиаком c выделением водорода и образованием амида, например:
2Na + 2NH3 = 2NaNH2 + H2
амид натрия
В атмосфере кислорода аммиак горит с образованием азота, на платиновом катализаторе аммиак окисляется до оксида азота(II):
t
4NH3 + 3O2 = 2N2 + 6H2O
t
4NH3 + 5O2 = 4NO + 6H2O
Pt
Аммиак очень хорошо растворим в воде, в которой проявляет свойства слабого основания:
NH3 + H2O ® NH3×H2O  NH4+ + OH-
NH4+ + OH-
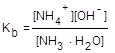 = 1,85·10-5
= 1,85·10-5
Как основание аммиак реагирует с кислотами, образуя соли катиона аммония, например:
NH3 + HCl = NH4Cl
Соли аммония хорошо растворимы в воде и слабо гидролизованы. В кристаллическом состоянии термически нестойки. Состав продуктов термолиза зависит от свойств кислоты, образующей соль:
t
NH4Cl ® NH3 + HCl
t
(NH4)2SO4 ® NH3 + (NH4)HSO4
t
(NH4)2Cr2O7 ® N2 + Cr2O3 + 4H2O
При действии на водные растворы солей аммония щелочей при нагревании выделяется аммиак, что позволяет использовать данную реакцию как качественную на соли аммония и как лабораторный метод получения аммиака.
t
NH4Cl + NaOH = NaCl + NH3 + H2О
В промышленности аммиак получают прямым синтезом.
p, t
N2 + 3H2  2NH3
2NH3
Kat
Поскольку реакция сильно обратима, синтез ведут при повышенном давлении (до 100 мПа). Для ускорения момента наступления равновесия процесс проводят в присутствии катализатора (губчатое железо, промотированное добавками) и при температуре около 500 °С.
Нитриды щелочных и щелочноземельных металлов представляют собой ионные соединения, легко разлагающиеся водой с образованием аммиака.
Li3N + 3H2O = 3LiOH + NH3
Нитриды d-металлов - кристаллические соединения переменного состава (бертолиды), очень тугоплавкие и химически устойчивые.
Гидразин - N2H4 - наиболее важное неорганическое соединение азота в степени окисления -2.
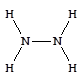
Гидразин представляет собой бесцветную жидкость, с температурой кипения 114 °С, дымящуюся на воздухе. Пары гидразина чрезвычайно ядовиты и образуют с воздухом взрывообразные смеси. Получают гидразин, окисляя аммиак гипохлоритом натрия:
2NH3 + NaClO = N2H4 + NaCl + H2O
Гидразин смешивается с водой в любых соотношениях и в растворе ведет себя как слабое двухкислотное основание, образуя два ряда солей.
N2H4 + H2O  N2H5+ + OH-, Kb = 9,3×10-7;
N2H5+ + OH-, Kb = 9,3×10-7;
N2H5+ + H2O  N2H62+ + OH-, Kb = 8,5×10-15;
N2H62+ + OH-, Kb = 8,5×10-15;
N2H4 + HCl  N2H5Cl; N2H5Cl + HCl
N2H5Cl; N2H5Cl + HCl  N2H6Cl2
N2H6Cl2
хлорид гидрозония дихлорид дигидрозония
Гидразин сильнейший восстановитель:
4KMnO4 + 5N2H4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Гидразин и его производные широко применяются в качестве ракетного топлива.
Гидроксиламин - NH2OH - основное неорганическое соединение азота в степени окисления -1.
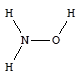
Гидроксиламин - бесцветное кристаллическое вещество (т.пл. 33 °С), хорошо растворимое в воде, в которой проявляет свойства слабого основания.
NH2OH + H2O  [NH3OH]+ + OH-, Kb = 2×10-8
[NH3OH]+ + OH-, Kb = 2×10-8
Получают гидроксиламин восстановлением азотной кислоты водородом в момент выделения при электролизе:
HNO3 + 6[H] = NH2OH + 2H2O
Атом азота в молекуле NH2OН проявляет промежуточную степень окисления (между -3 и +5) поэтому гидроксиламин может выступать как в роли восстановителя, так и в роли окислителя:
2N-1H2OH + I2 + 2KOH = N02 + 2KI + 4H2O
восстановитель
2N-1H2OH + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (N-3H4)2SO4 + 2H2O
окислитель
Положительные степени окисления азот проявляет в оксидах, а также кислородсодержащих кислотах и их солях.
Оксид азота(I) - N2O(закись азота, веселящий газ). Строение его молекулы можно передать резонансом двух валентных схем, которые показывают, что рассматривать это соединение как оксид азота(I) можно только формально, реально это оксонитрид азота(V) - ON+5N-3.
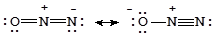
N2O - бесцветный газ со слабым приятным запахом. В малых концентрациях вызывает приступы безудержного веселья, в больших дозах оказывает общее анестезирующее действие. Смесь закиси азота (80%) и кислорода (20%) используется в медицине для наркоза.
В лабораторных условиях оксид азота(I) можно получить разложением нитрата аммония:
t
NH4NO3 ¾® N2O + 2H2O
N2O, полученный данным методом, содержит примеси высших оксидов азота, которые чрезвычайно токсичны!
По химическим свойствам оксид азота(I) типичный несолеобразующий оксид, с водой, кислотами и щелочами не реагирует. При нагревании разлагается с образованием кислорода и азота. По этой причине N2O может выступать в роли окислителя, например:
t
N2O + H2 = N2 + H2O
Оксид азота(II) - NO - бесцветный газ, чрезвычайно токсичен. На воздухе быстро окисляется кислородом с образованием не менее токсичного оксида азота(IV). В промышленности NO получают, пропуская воздух через электрическую дугу (3000-4000 °С).
t
N2 + O2 = 2NO
Лабораторным методом получения оксида азота(II) является взаимодействие меди с разбавленной азотной кислотой.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Оксид азота(II) - несолеобразующий оксид, сильный восстановитель, легко реагирует с кислородом и галогенами.
2NO + O2 = 2NO2; 2NO + Cl2 = 2NOCl
хлористый нитрозил
В то же время, при взаимодействии с сильными восстановителями NO выполняет функцию окислителя:
t
2NO + 2H2 = N2 + 2H2O
Оксид азота(III) - N2O3 - жидкость интенсивно синего цвета (т.кр. - 100 °С). Устойчив только в жидком и твердом состоянии при низких температурах. По-видимому, существует в двух формах:
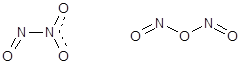
Получают оксид азота(III) совместной конденсацией паров NO и NO2. В жидкости и в парах диссоциирует.
NO2 + NO  N2O3
N2O3
По свойствам типичный кислотный оксид. Реагирует с водой, образуя азотистую кислоту, с щелочами образует соли - нитриты.
N2O3 + H2O = 2HNO2
N2O3 + 2NaOH = 2NaNO2 + H2O
Азотистая кислота - кислота средней силы (Ka = 1×10-4). В чистом виде не выделена, в растворах существует в двух таутомерных формах (таутомеры - изомеры, находящиеся в динамическом равновесии.)
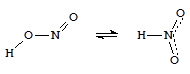
нитрито-форма нитро-форма
Соли азотистой кислоты устойчивы. Нитрит-анион проявляет ярко выраженную окислительно-восстановительную двойственность. В зависимости от условий он может выполнять как функцию окислителя, так и функцию восстановителя, например:
2NaNO2 + 2KI + 2H2SO4 = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
окислитель
KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
восстановитель
Азотистая кислота и нитриты склонны к диспропорционированию:
t
3HN+3O2 = HN+5O3 + 2N+2O + H2O
Оксид азота(IV) - NO2 - бурый газ, с резким неприятным запахом, чрезвычайно токсичен! В промышленности NO2 получают окислением NO. Лабораторным методом получения NO2 является взаимодействие меди с концентрированной азотной кислотой, а также термическое разложение нитрата свинца.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
t
2Pb(NO3)2 = 2PbO + 4NO2 + O2
Молекула NO2 имеет один неспаренный электрон и является стабильным свободным радикалом. Поэтому оксид азота легко димеризуется. Процесс обратим и очень чувствителен к температуре.
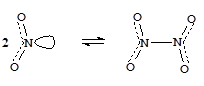
-11 °C
2NO2  N2O4
N2O4
+150 °C
парамагнитен, диамагнитен,
бурый бесцветен
Диоксид азота - кислотный оксид, взаимодействует с водой, образуя смесь азотной и азотистой кислоты (смешанный ангидрид).
2NO2 + H2O = HNO2 + HNO3
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Оксид азота(V) - N2O5 - белое кристаллическое вещество. Получается дегидратацией азотной кислоты или окислением оксида азота(IV) озоном:
2HNO3 + P2O5 = N2O5 + 2HPO3
2NO2 + O3 = N2O5 + O2
В кристаллическом состоянии N2O5 имеет солеподобное строение - [NO2]+[NO3]-, в парах (т.возг. 33 °С) - молекулярное.
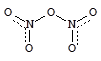
N2O5 - кислотный оксид - ангидрид азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота - HNO3 - бесцветная жидкость с температурой кипения 84,1 °С, при нагревании и на свету разлагается.
4HNO3 = 4NO2 + O2 + 2H2O
Примеси диоксида азота придают концентрированной азотной кислоте желто-бурую окраску. С водой азотная кислота смешивается в любых соотношениях и является одной из сильнейших минеральных кислот, в растворе нацело диссоциирует:
Азотная кислота - один из сильнейших окислителей. Глубина ее восстановления зависит от многих факторов: концентрация, температура, восстановитель. Обычно при окислении азотной кислотой образуется смесь продуктов восстановления:
HN+5O3 ® N+4O2 ® N+2O ® N+12O ® N02 ® [N-3H4]+
Превалирующим продуктом окисления концентрированной азотной кислотой неметаллов и неактивных металлов является оксид азота(IV):
I2 + 10HNO3(конц) = 2HIO3 + 10NO2 + 4H2O
Pb + 4HNO3(конц) = Pb(NO3)2 + 2NO2 + 2H2O
Концентрированная азотная кислота пассивирует железо и алюминий. Алюминий пассивируется даже разбавленной азотной кислотой. Азотная кислота любой концентрации не действует на золото, платину, тантал, родий и иридий. Золото и платина растворяется в царской водке - смесь концентрированной азотной и соляной кислот в соотношении 1 : 3:
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Сильное окисляющее действие царской водки обусловлено образование атомарного хлора при распаде хлористого нитрозила - продукта взаимодействия азотной кислоты с хлороводородом.
HNO3 + 3HCl = Cl2 + NOCl + 2H2O
NOCl = NO + Cl×
Эффективным растворителем малоактивных металлов является смесь концентрированной азотной и плавиковой кислот.
3Ta + 5HNO3 + 21HF = 3H2[TaF7] + 5NO + 10H2O
Разбавленная азотная кислота при взаимодействии с неметаллами и малоактивными металлами восстанавливается преимущественно до оксида азота(II), например:
3P + 5HNO3(разб) + 2H2O = 3H3PO4 + 5NO
3Pb + 8HNO3(разб) = 3Pb(NO3)2 + 2NO + 4H2O
Активные металлы восстанавливают разбавленную азотную кислоту до N2O, N2 или NH4NO3, например,
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Соли азотной кислоты - нитраты хорошо растворимы в воде, термически неустойчивы. Разложение нитратов активных металлов (исключая литий), стоящих в ряду стандартных электродных потенциалов левее магния, приводит к образованию нитритов.
t
2KNO3 = 2KNO2 + O2
При разложении нитратов лития, магния, а также нитратов металлов, расположенных в ряду стандартных электродных потенциалов правее магния, вплоть до меди, выделяется смесь оксида азота(IV) и кислорода.
t
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Нитраты металлов, расположенных в конце ряда активности, разлагаются до свободного металла:
t
2AgNO3 = 2Ag + 2NO2 + O2
Нитраты натрия, калия и аммония широко используются для производства пороха и взрывчатых веществ, а также в качестве азотных удобрений (селитры). В качестве удобрений используют также сульфат аммония, аммиачную воду и карбамид (мочевину) - полный амид угольной кислоты H2N-C(O)-NH2. Основная масса азотной кислоты идет на производство удобрений и взрывчатых веществ.
Получают азотную кислоту в промышленности контактным или дуговым способом, которые отличаются первой стадией - получением оксида азота(II). Дуговой способ основан на получении NO при пропускании воздуха через электрическую дугу. В контактном способе NO получают окислением аммиака кислородом на платиновом катализаторе. Далее оксид азота(II) окисляется до оксида азота(IV) кислородом воздуха. Растворяя NO2 в воде в присутствии кислорода получают азотную кислоту с концентрацией 60-65%.
4NO2 + O2 + 2H2O = 4HNO3
При необходимости азотную кислоту концентрируют перегонкой с концентрированной серной кислотой. В лаборатории концентрированную азотную кислоту можно получить действием концентрированной серной кислоты на кристаллический нитрат натрия при нагревании.
t
NaNO3 + H2SO4 = HNO3 + NaHSO4
21.2. Фосфор и его соединения
Фосфор представлен в природе одним изотопом - 31Р, кларк фосфора равен 0,05 мол.%. Встречается в виде фосфатных минералов: Ca3(PO4)2 - фосфорит, Ca5(PO4)3X (X = F,Cl,OH) - апатиты. Входит в состав костей и зубов животных и человека, а также в состав нуклеиновых кислот (ДНК и РНК) и аденозинфосфорных кислот (АТФ, АДФ и АМФ).
Получают фосфор восстановлением фосфорита коксом в присутствии диоксида кремния.
t
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Простое вещество - фосфор - образует несколько аллотропных модификаций, из которых основными являются белый, красный и черный фосфор. Белый фосфор образуется при конденсации паров фосфора и представляет собой белое воскоподобное вещество (т.пл. 44 °С), нерастворимое в воде, растворимое в некоторых органических растворителях. Белый фосфор имеет молекулярное строение и состоит из тетраэдрических молекул P4.
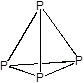
Напряженность связей (валентный угол P-P-P составляет всего 60 °) обусловливает высокую реакционную способность и токсичность белого фосфора (смертельная доза около 0,1 г). Поскольку белый фосфор хорошо растворим в жирах, в качестве антидота при отравлении нельзя применять молоко. На воздухе белый фосфор самопроизвольно воспламеняется, поэтому хранят его в герметически упакованной химической посуде под слоем воды.
Красный фосфор имеет полимерное строение. Получается при нагревании белого фосфора или облучении его светом. В отличие от белого фосфора малореакционноспособен и нетоксичен. Однако остаточные количества белого фосфора могут придавать красному фосфору токсичность!
Черный фосфор получается при нагревании белого фосфора под давлением 120.000 атм. Имеет полимерное строение, обладает полупроводниковыми свойствами, малореакционен и нетоксичен.
Химические свойства. Белый фосфор самопроизвольно окисляется кислородом воздуха при комнатной температуре (окисление красного и черного фосфора идет при нагревании). Реакция протекает в два этапа и сопровождается свечением (хемилюминисценция).
t t
2P + 3O2 = 2P2O3; P2O3 + O2 = P2O5
Ступенчато происходит также взаимодействие фосфора с серой и галогенами.
t t
2P + 3Cl2 = 2PCl3; PCl3 + Cl2 = PCl5
При взаимодействии с активными металлами фосфор выступает в роли окислителя, образуя фосфиды - соединения фосфора в степени окисления -3.
t
3Ca + 2P = Ca3P2
Кислотами-окислителями (азотная и концентрированная серная кислоты) фосфор окисляется до фосфорной кислоты. При кипячении с растворами щелочей белый фосфор диспропорционирует:
t
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
фосфин гипофосфит калия
Соединения фосфора
Соединения фосфора в степени окисления -3 представлены фосфином - PH3 - и фосфидами металлов.
Фосфин - бесцветный газ, с характерным неприятным запахом чеснока, очень токсичен! На воздухе самопроизвольно воспламеняется, в воде малорастворим. В отличие от аммиака образует соли только с очень сильными кислотами.
PH3 + О2 = Р2O5 + H2O; PH3 + HI = РH4I
иодид фосфония
Образуется фосфин при диспропорционировании белого фосфора в щелочных растворах. Лабораторным методом получения является гидролиз фосфидов:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Фосфиды щелочных и щелочноземельных металлов представляют собой типичные ионные соединения, гидролитически неустойчивы. Фосфиды d-металлов являются соединениями переменного состава (бертолидами), обычно тугоплавки и малореакционноспособны.
Наиболее важными соединениями фосфора в степени окисления -1 являются фосфорноватистая кислота и ее соли - гипофосфиты.
Фосфорноватистая кислота - H[H2PO2] - бесцветное кристаллическое вещество, хорошо растворимое в воде, сильная одноосновная кислота (Ka = 8×10-2).
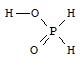
Фосфорноватистая кислота и гипофосфиты - сильные восстановители. При нагревании фосфорноватистая кислота диспропорционирует.
t
3H[H2PO2] = PH3 + 2H2[HPO2]
фосфористая кислота
Степень окисления +3 фосфор имеет в галогенидах, оксиде, фосфористой кислоте и ее солях - фосфитах. PF3 - газ, PCl3 и PBr3 – жидкости, дымящиеся на воздухе вследствие гидролиза.
PCl3 + 3H2O = H[H2PO3] + 3HCl
Оксид фосфора(III) - P2O3 (точнее P4O6) - бесцветное кристаллическое вещество, имеет молекулярное строение.
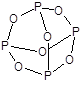
По химическим свойствам типичный кислотный оксид - ангидрид фосфористой кислоты.
P2O3 + 3H2O = 2H2[HPO3]; P2O3 + 4NaOH = 2Na2[HPO3] + H2O
Фосфористая кислота - H2[HPO3] - бесцветные гигроскопичные кристаллы, хорошо растворимые в воде. H2[HPO3] является сильной двухосновной кислотой (K1 = 2×10-2, K2 = 6×10-7).
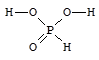
Соли фосфористой кислоты - фосфиты - сильные восстановители.
HgCl2 + H2[HPO3] + H2O = H3PO4 + Hg + 2HCl
Основные соединения фосфора в степени окисления +5: PHal5, POHal3 (Hal = F, Cl, Br), P2O5, H3PO4 и ее соли.
Фторид фосфора(V) - газообразное вещество, молекула которого имеет геометрию тригональной бипирамиды:
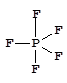
Аналогичное строение имеют другие галогениды фосфора(V) в газообразном состоянии. В кристаллах их строение соответствует следующим формулам: [PCl4]+[PCl6]-, [PBr4]+Br-. Галогениды фосфора - реакционноспособные и гидролитически неустойчивые соединения.
PF5 + HF = H[PF6]
PCl5 + 4H2O = H3PO4 + 5HCl
Оксогалогениды фосфора(V) также гидролитически неустойчивы, например:
POCl3 + 3H2O = H3PO4 + HCl
Широко применяются в органической химии для получения хлорсодержащих и фосфорорганических соединений.
Оксид фосфора(V) - P2O5, точнее P4O10 - бесцветное снегоподобное вещество.
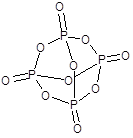
Типичный кислотный оксид, реакция с водой идет ступенчато и приводит в конечном итоге к образованию ортофосфорной кислоты:
t
P2O5 + H2O = 2HPO3; HPO3 + H2O = H3PO4
метафосфорная кислота ортофосфорная кислота
Повышенное сродство к воде позволяет использовать оксид фосфора(V) для осушки газов и органических растворителей, а также в качестве водоотнимающего средства:
P2O5 + 2HClO4 = 2HPO3 + Cl2O7
Присоединение фосфорного ангидрида к фосфорной кислоте приводит к образованию ряда полифосфорных кислот, простейшей из которых является дифосфорная (пирофосфорная) кислота - H4P2O7.
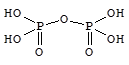
Ортофосфорная кислота - H3PO4 - бесцветные гигроскопичные кристаллы (т.пл. 42 °С) неограниченно растворимые в воде.
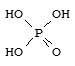
Кислота средней силы при диссоциации по первой ступени (K1 = 8×10-3), слабая - при диссоциации по второй и третьей ступеням (K2 = 6×10-8, K3 = 1×10-12). Образует три ряда солей: NaH2PO4 - дигидрофосфат натрия; Na2HPO4 - гидрофосфат натрия; Na3PO4 - фосфат (ортофосфат) натрия.
Фосфаты щелочных металлов и аммония хорошо растворимы в воде. Фосфаты остальных металлов малорастворимы. Переход к кислым солям сопровождается заметным повышением растворимости. Фосфаты щелочноземельных металлов и аммония применяются в качестве фосфорных удобрений: Ca3(PO4)2 - фосфоритная мука; CaHPO4×2H2O - преципитат; Ca(H2PO4)2×H2O - двойной суперфосфат; Ca(H2PO4)2×H2O + 2CaSO4 - суперфосфат; NH4H2PO4 + (NH4)2HPO4 - аммофос. Широко применяются комбинированные удобрения, содержащие несколько питательных элементов: аммофос + KNO3 - азофоска; (NH4)2HPO4 + NH4NO3 + KCl - нитрофоска
Фосфор образует значительное количество фосфорганических соединений, в которых он связан с органическими радикалами. Многие из них обладают ярко выраженным физиологическим действием, например:
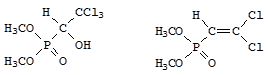
хлорофос дихлофос
21.3. Элементы подгруппы мышьяка
Мышьяк, сурьма и висмут довольно редкие элементы: кларк Аs равен 1,5×10-4; Sb - 5×10-6; Bi - 1,7×10-6 мол.%. Встречаются в основном в виде сульфидных минералов: As2S3 - аурипигмент, As4S4 - реальгар, FeAsS - арсенопирит, Sb2S3 - сурьмяный блеск, Bi2S3 - висмутовый блеск. Простые вещества образуют несколько аллотропных модификаций.
В ряду As - Sb - Bi происходит увеличение эффективного атомного радиуса и уменьшение электроотрицательности, в связи с чем наблюдается постепенное ослабевание неметаллических и нарастание металлических свойств. Мышьяк - полупроводник с преобладание неметаллических свойств, сурьма - полупроводник, у которого сильнее выражены свойства металла, висмут - металл.
3As + 5HNO3(конц) + 2H2O = 3H3AsO4 + 5NO
6Sb + 10HNO3(конц) + 4H2O = 3Sb2O5×3H2O + 10NO
Bi + 4HNO3(разб) = Bi(NO3)3 + NO + 2H2O
Гидриды - H3As - арсин, H3Sb - стибин, H3Bi - висмутин. Газообразные вещества с резким неприятным запахом. Устойчивость гидридов в ряду As - Sb - Bi резко падает. На образовании мышьякового зеркала при разложении арсина основана проба Марша - обнаружение соединений мышьяка в биологических объектах.
t
2H3As = 3H2 + 2As¯
Оксид мышьяка(III) кислотный, взаимодействует с водой, образуя мышьяковистую кислоту, с щелочами образует соли - арсениты.
As2O3 + 3H2O = 2H3AsO3
As2O3 + 6NaOH = 2Na3AsO3 + 3H2O
Оксид сурьмы(III) в воде нерастворим, но взаимодействует со щелочами и соляной кислотой, проявляя свойства амфотерного оксида.
Sb2O3 + 2NaOH + 3H2O = 2Na[Sb(OH)4]
Sb2O3 + 8HCl = 2H[SbCl4] + 3H2O
Оксид висмута(III) в воде нерастворим, со щелочами не реагирует, но взаимодействует с кислотами. Соли Bi(III) многообразны и устойчивы, сильно гидролизуются.
Оксиды мышьяка(V) и сурьмы(V) проявляют отчетливо выраженные кислотные свойства.
As2O5 + 3H2O = 2H3AsO4
Sb2O5 + 2KOH + 5H2O = 2K[Sb(OH)6]
Мышьяковая кислота - H3AsO4 - кислота средней силы (К1 = 6×10-3). Кислота и её соли -арсенаты - сильные окислители.
K3AsO4 + 2KI + H2SO4 = K3AsO3 + I2 + K2SO4 + H2O
Соединения висмута(V) неустойчивы. Все растворимые соединения мышьяка и сурьмы чрезвычайно ядовиты!
Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371
Дата добавления: 2017-10-04; просмотров: 1807;











