Аллотропные формы углерода – «нано» и «не нано»
Углеродные наноматериалы
Среди широкого спектра существующих наноматериалов мы в первую очередь обратимся к простым веществам, которые образованы углеродом. Углерод – уникальный элемент: он единственный среди всех может образовывать длинные (до сотен тысяч атомов) цепочки связанных между собой атомов – углеродные скелеты органических молекул. Благодаря особой прочности связей С–С углеродный скелет молекул остается неизменным в большинстве химических реакций. Кроме того, атомы углерода могут образовать между собой разные виды связей: одинарные, двойные и тройные, каждой из которых соответствует свое гибридное состояние атома углерода.
Именно разнообразием углеродных скелетов и типов химических связей между атомами углерода объясняется большое число известных к настоящему времени аллотропных форм углерода. Из них две формы – алмаз и графит – известны человечеству с незапамятных времен, а молекулярная форма (фуллерены) и «наноформы» (наноалмаз и нанотруб-ки) открыты всего несколько десятилетий назад.
Устойчивых аллотропных форм углерода только две – графит и алмаз. Об этом свидетельствует диаграмма состояния углерода, которая в координатах «p–T» показывает области существования термодинамически стабильных состояний вещества (рис. 1).
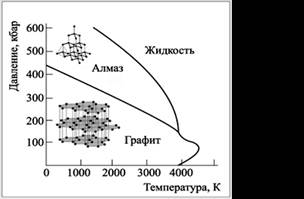
|
| Рис. 1. Диаграмма состояния углерода |
Из диаграммы видно, что при обычных условиях самая устойчивая форма углерода – графит. Именно в него, согласно основному постулату термодинамики, рано или поздно должны превратиться все другие формы, включая алмаз. Однако скорость подобных превращений настолько мала, что практически, за разумное время, этого не происходит. Для получения алмаза надо создать экстремальные условия, в первую очередь высокое давление – несколько сот тысяч атмосфер.
Мы видим также, что на диаграмме состояния нет ни фуллеренов, ни нанотрубок. Все это – неравновесные, или термодинамически нестабиль-ные, формы углерода. Ни при каких условиях они не могут быть устойчи-вее графита или алмаза.
Наноалмазы
Среди всех «наноформ» углерода наноалмазы ближе всего к природ-ному состоянию углерода. Напомним, что обычный алмаз образует очень прочную атомную кристаллическую решетку, в которой каждый атом углерода находится в sp3-гибридном состоянии и соединен одинарными связями с четырьмя соседними, расположенными в вершинах тетраэдра (рис. 1).
Наноалмазы имеют такую же кристаллическую структуру, как и обычный алмаз, но их кристаллы значительно меньше по размерам: от 2 до 8 нм. Квантово-химические расчеты частицы алмаза, содержащей 275 атомов (рис. 2, а), показали, что эти циклы соединены между собой так же, как и в структуре фуллерена C60, которую мы рассмотрим позже. Таким образом, при комнатной температуре наночастица алмаза имеет «алмазное» ядро и «фуллереновую» поверхность (рис. 2, б).

|
| Рис. 2 Объемная структура алмаза (а); наночастица алмаза с фуллереноподобной поверхностью (б) |
Большая доля связей на поверхности наноалмазов приводит к тому, что она очень активна, и благодаря этому реакционная способность нанокристаллов алмаза намного выше, чем у кристаллов обычных размеров. Обычный алмаз переходит в графит при нагревании в инертной атмосфере до 1800 оС, а наноалмаз – всего до 1000 °C. Обычный алмаз окисляется на воздухе только при температуре выше 900 °C, а наноалмаз – уже при 450 °C.
Размер частиц влияет не только на химические, но и на термодинамические свойства алмаза. Так, при комнатной температуре обычный алмаз считается эндотермическим веществом, т.к. теплота реакции его образования из графита отрицательная. Напротив, алмаз с диаметром частиц 5 нм – экзотермическое вещество.
Атомы углерода, находящиеся на поверхности, в отличие от атомов в объеме, имеют свободные валентности и могут присоединять атомы других элементов. Наличие активных групп атомов облегчает химическую модификацию поверхности и создает возможности управления свойствами наноалмазов. Во всем остальном наноалмазы обладают свойствами обычных алмазов, в частности очень высокой твердостью и химической инертностью.
Получают наноалмазы, главным образом, детонационным синтезом – этот способ был изобретен в Советском Союзе еще до наступления эры нанотехнологий. При взрыве смеси тротила и гексогена в отсутствие кислорода в эпицентре взрыва создается температура свыше 3000 °С, а давление – более 200 тыс. атмосфер. В этих условиях более устойчивой формой углерода оказывается не графит, а алмаз. Время реакции составляет всего 100–500 наносекунд – за такой малый промежуток крупные кристаллы алмаза не успевают сформироваться, поэтому большинство кристаллов представляют собой наночастицы. Для удаления графита полученную смесь нагревают до 250 °С со смесью концентрированных азотной и серной кислот. Кислоты-окислители растворяют графит, но не действуют на алмаз. Чистота получаемых наноалмазов достигает 99,5 %.
Детонационный наноалмаз представляет собой черно-серый, очень мелкий порошок со средним размером зерен 20–50 нм. Каждое зерно состоит из нескольких десятков кристаллов, имеющих почти идеальную сферическую форму. Интересно, что диаметр кристаллов почти не зависит от условий детонации и составляет всегда от 2 до 8 нм.
Другой метод получения наноалмазов – химическое осаждение из газовой фазы (CVD). Алмаз осаждается на твердой поверхности (подложке) в результате химических реакций, протекающих с газообразными веществами. Обычно используют разложение углеводородов – метана и ацетилена – или более сложных органических соединений при нагревании до 600–800 °С. При химическом осаждении на поверхности подложки получают тонкие алмазные пленки различной толщины. В качестве подложки обычно используют кремний.
Обратимся к практическим применениям наноалмазов. Самые очевидные из них связаны с механическими свойствами этого материала. Наноалмазы в виде пасты применяют как абразивный материал для сверхтонкой полировки поверхностей, с их помощью можно получить зеркальную поверхность твердых тел любой геометрической формы, не имеющую дефектов. Создание композиционных материалов из наноалмазов с металлами дает возможность заметно повысить твердость металлических покрытий и их устойчивость к износу. Введение наноалмазов в состав полимеров, резины и пластмасс также увеличивает их прочность, рабочий диапазон температур и срок службы.
Другие области применения наноалмазов основаны на их поверхностной активности. Наноалмазы имеют высокую удельную поверхность, химическую природу которой можно изменять путем введения различных функциональных групп. Кроме того, доказано, что наночастицы алмаза биосовместимы и обладают низкой токсичностью. Все это позволяет использовать их в биологии и медицине. Так, в биологии наноалмазы уже применяют в качестве сорбентов для выделения и очистки белков методами хроматографии. В медицине они могут использоваться как адсорбенты для выведения из организма нежелательных и токсичных соединений, а также как носители препаратов, применяемых в лечеб-ных целях. Интенсивные исследования в этой области сейчас проводятся на животных.
Дата добавления: 2016-10-26; просмотров: 2853;











