Соединения алюминия
В стабильных соединениях алюминий проявляет степень окисления +3, образуя оксид, гидроксид и соли.
Оксид алюминия существует в нескольких модификациях, основной из которых является a-Al2O3 (корунд) - твердое, тугоплавкое соединение (т.пл. 2050 °С). По твердости уступает только алмазу, эльбору и карборунду. Очень устойчивое соединение, не реагирующее с водными растворами кислот и щелочей. При сплавлении проявляет свойства амфотерного оксида:
t
Al2O3 + 2NaOH = 2NaAlO2 + H2O
t
Al2O3 + 3K2S2O7 = Al2(SO4)3 + 3K2SO4
Гидроксид алюминия выделяется при действии аммиака на водные растворы солей алюминия:
Al3+ + 3NH3×H2O = Al(OH)3¯ + 3NH4+
Свежеполученный Al(OH)3 реакционноспособное вещество, типичный амфотерный гидроксид, растворимый в растворах кислот и щелочей:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3KOH = K3[Al(OH)6]
Со временем гидроксид алюминия теряет активность за счет частичной потери воды и образования полимерных структур.
Фторид алюминия представляет собой полимерное вещество, нерастворимое в воде и органических растворителях. Хлорид, бромид и иодид алюминия - летучие кристаллические вещества, растворимые в органических растворителях, в парах и в инертных растворителях существуют в виде димерных молекул:
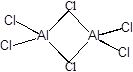
Галогениды алюминия - сильные кислоты Льюиса, энергично присоединяют электронодонорные молекулы, очень энергично растворяются в воде, иодид алюминия со взрывом.
Большинство солей алюминия хорошо растворимы в воде, сильно гидролизованы. Соли алюминия со слабыми кислотами гидролитически неустойчивы и существуют только в безводных условиях. Например:
Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S
Наибольшее применение находит сульфат алюминия и алюмокалиевые квасцы - K2SO4×Al2(SO4)3×24H2O.
23.3. Подгруппа галлия
Галлий, индий и таллий - рассеянные элементы, самостоятельных месторождений практически не образуют, входят в состав некоторых полиметаллических руд. Легкоплавкие серебристо-белые металлы. Подобно алюминию галлий и индий на воздухе покрыты пассивирующей пленкой. Таллий на воздухе медленно окисляется. При нагревании реагируют с кислородом, серой и галогенами. Растворимы в кислотах. При этом галлий и индий образуют соли в степени окисления +3, а таллий образует соли таллия(I).
2Ga + 3H2SO4 = Ga2(SO4)3 + 3H2
2Tl + H2SO4 = Tl2SO4 + H2
Галлий реагирует со щелочами, индий и таллий в отсутствие окислителей к щелочам устойчивы.
Оксиды и гидроксиды галлия(III) и индия(III) амфотерны. Для оксида и гидроксида таллия(III) наблюдается сильное доминирование основных свойств. Галогениды и соли галлия, индия и таллия(III) напоминают по свойствам галогениды и соли алюминия.
Соединения галлия и индия(I) неустойчивы, сильные восстановители. Для соединений таллия степень окисления +1 наиболее устойчива. Оксид таллия хорошо растворим в воде, с которой реагирует подобно оксидам щелочных металлов:
Tl2O + H2O = 2TlOH
Гидроксид таллия(I) - сильное основание, отщепляющее воду при нагревании. Соли таллия(I) напоминают соли серебра(I). Соединения галлия, индия и особенно таллия ядовиты!
Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446
Дата добавления: 2017-10-04; просмотров: 1603;











