АБСОРБЦИОННАЯ ОЧИСТКА ГАЗОВ ОТ ДИОКСИДА УГЛЕРОДА
5.1.1. Абсорбций диоксида углерода водой
Абсорбция диоксида углерода (С02) водой имеет промышленное
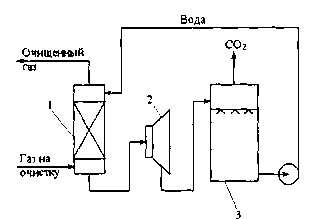 Рис. 5.1. Схема установки для очистки газа от диоксида углерода водой
I - абсорбер; 2 - рекуперационная турбина; 3 - десорбер
Рис. 5.1. Схема установки для очистки газа от диоксида углерода водой
I - абсорбер; 2 - рекуперационная турбина; 3 - десорбер
|
значение для очистки некоторых газов высокого давления, в частности, применяемых для синтеза аммиака. Водная очистка представляет собой типичный процесс физической абсорбции. Основными преимуществами воды как абсорбента для удаления примесей из газа является ее доступность и дешевизна. Применение любого абсорбента, кроме воды, связано с необходимостью создания герметичной системы и рекуперации, т.к. в процессе очистки он улетучивается и отходящие газы
загрязняют атмосферу. Воду можно применять в простых скрубберах с меньшей опасностью утечки газа и во многих случаях без рециркуляции со сбросом насыщенного раствора. Часто, чтобы увеличить растворимость С02 в воде, процесс проводят при повышенном давлении.
Принципиальная схема процесса приведена на рис. 5.1.
В простейшем варианте установка состоит только из абсорбера 1, работающего' при повышенном давлении, десор-бера 3, в котором вследствие снижения давления из воды выделяется С02. На схеме показана также рекуперационная турбина 2, позволяющая использовать
часть энергии путем снижения давления жидкости и последующего
расширения абсорбированного газа.
Такой процесс обычно применяется для очистки газов с парциальным давлением С02 более 3,4 атм, так как только при таком давлении достигается эффективная поглотительная емкость воды. Так как газы синтеза аммиака обычно содержат около 25 % С02, этот фактор практически ограничивает применимость процесса системами, избыточное давление абсорбции в которых выше примерно 14 атм.
Основные преимущества водной очистки: простота конструкции установки, отсутствие теплообменников и кипятильников; отсутствие расхода тепла; дешевизна растворителя; отсутствие паров дорогого или токсичного растворителя, переходящего в газовую фазу.
Основные недостатки процесса водной абсорбции: чрезмерно большие потери газа при высоком давлении вследствие значительного повышения его растворимости; низкая поглотительная емкость воды по С02 (8 кг С02 на 100 кг воды); значительный расход в связи с этим энергии на перекачку раствора; недостаточная чистота С02.
5.1.1. Очистка газа от диоксида углерода метанолом
Метанол и ряд других органических растворителей являются хорошими поглотителями С02. При понижении температуры абсорбента и повышении давления в системе поглотительная способность резко повышается. На этом свойстве основан процесс “ректизол”. При температуре - 60 °С и атмосферном давлении (0,1 МПа) растворимость составляет 75 см3/г, с увеличением давления до 0,4 МПа она достигает 600 см3/г. Растворение протекает со значительным экзотермическим эффектом.
Избирательность метанола в отношении смеси С02-водород в 7 раз выше избирательности воды, поэтому потери водорода в процессе его очистки метанолом значительно ниже, чем при водной очистке.
Схема очистки включает охлаждение газа до -35 °С при прямом контакте с хладоагентом - 60 % - ным водным раствором метанола; очистку ведут в трехсекционной колонне при температуре -35 - 60 °С и давлении 2 МПа, а десорбцию - путем последовательного снижения давления до 800, 130, 60 и 25 кПа. В результате очистки газа, полученного конверсией оксида углерода (71,5 % Н2; 0,8 N2, 0,9 % СН4; 2,4 % СО; 24,4 % С02) образуется газ состава 92,8 % Н2; 1,1 % СН4; 3,1 % СО; 2,0 % С02. Полная регенерация метанола достигается его кипячением.
Процесс “ректизол” отличается высокой экономичностью, его основной недостаток заключается в громоздкости аппаратуры. Процесс наиболее целесообразно применять при очистке газа с большим содержанием примесей, например, коксового, а также в тех случаях, когда газ в конечном итоге должен подвергаться глубокому охлаждению.
5.1.2. Очистка газов от диоксида углерода растворами этаноламинов
Этаноламиновая очистка - наиболее распространенный метод очистки промышленных газов. В качестве поглотителей могут быть применены моно-, ди- и триэтаноламины (МЭА, ДЭА, ТЭА):
| OH-CH2-CH2-NH2 МЭА | (OH-CH2CH2)2NH ДЭА | (CH2CH2OH)3N ТЭА |
Каждое из этих соединений содержит, по крайней мере, одну гидроксильную и одну аминогруппу. Присутствие гидроксильной группы снижает давление насыщенных паров и повышает растворимость соединений в воде, а аминогруппа придает водным растворам щелочность, необходимую для абсорбции кислых газов.
Растворы этаноламинов в равной степени поглощают как С02, так и сероводород. При этом протекают следующие реакции:
2RNH2 + С02 + Н20 = (RNH3)2C03;
(RNH3)2C03 + С02 + Н20 = 2RNH3HC03;
2RNH2+ С02 = RNHCOONH3R;
2RNH2 + H2S = (RNH3)2S;
(RNH3)2S + H2S = 2RNH3HS,
Как видно из этих уравнений, процесс ведет к образованию химических соединений. Однако эти уравнения можно рассматривать лишь как суммарную схему поглощения С02 растворами МЭА, устанавливающую принципиальную возможность получения в качестве конечного продукта как карбоната, так и бикарбоната моноэтаноламмония. Функциональные группы МЭА определяют два пути взаимодействия МЭА с С02, но, как правило, МЭА вступает в реакцию, характерную для аминосоединения.
Выбор рабочего раствора
Для извлечения С02 и H2S обычно применяют растворы МЭА, за исключением случаев, когда желательно применение других аминов, например, если в газе содержатся примеси, вступающие в необратимую реакцию с МЭА; при необходимости избирательной абсорбции одного из кислых компонентов (С02 или H2S) и для снижения потерь паров.
Предпочтительность МЭА вызвана в основном его низкой стоимостью, высокой реакционной способностью, стабильностью, легкостью регенерации. Однако МЭА присущи два важных недостатка: относительно высокое давление паров и способность в условиях работы установок очистки газов вступать в необратимую реакцию с серооки- сью углерода COS и сероуглеродом CS2 - компонентами газа крекинга. Первый из этих недостатков можно устранить простой водной промывкой газа для поглощения паров амина. Из-за второго недостатка применение МЭА ограничивается только очисткой природного и некоторых других газов, не содержащих сероокиси углерода (или сероуглерода). Для нефтезаводских газов, предпочтительно использовать ДЭА. Для избирательной абсорбции сероводорода в присутствии С02 можно применять один из третичных аминов.
Концентрация раствора амина может изменяться в широких пределах. Обычно ее выбирают на основании опыта работы и по соображениям борьбы с коррозией. На установках МЭА очистки концентрация раствора лежит в пределах 15-20 %.
Добавление гликоля к раствору, применяемому для очистки газа, заметно изменяет характер процесса. Этот процесс, называемый обычно гликоль-аминовой очисткой, широко используют для очистки природного газа высокого давления. Для этого чаще всего применяют смеси диэтиленгликоля (ДЭГ) и МЭА, содержащие около 5 % воды. Процесс имеет два важных преимущества: происходят одновременная очистка газа и его осушка и снижается расход водяного пара по сравнению с МЭА очисткой. К недостаткам процесса относятся повышенные потери амина из-за его испарения и несколько большая трудность очистки загрязненных растворов.
Варианты технологических схем
На рис. 5.2 показана основная технологическая схема абсорбционной очистки газов раствором алканоламина. Поступающий на очистку газ проходит восходящим потоком через абсорбер навстречу потоку раствора. Насыщенный раствор, выходящий с низа абсорбера, подогревается в теплообменнике регенерированным раствором из отпарной колонны и подается в верх ее. После частичного охлаждения в теплообменнике регенерированный раствор дополнительно охлаждается водой или воздухом и подается в верх абсорбера; этим завершается цикл. Кислый газ из отпарной колонны охлаждается для конденсации большей части содержащихся в нем водяных паров. Этот конденсат непрерывно возвращается обратно в систему, чтобы предотвратить увеличение концентрации раствора амина. Обычно всю эту воду или часть ее подают в верх отпарной колонны несколько выше входа насыщенного раствора для конденсации паров амина из потока кислого газа.
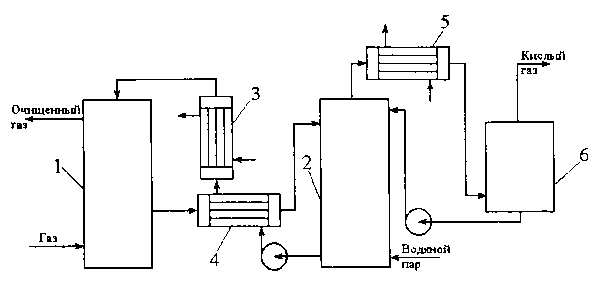 Рис. 5.2. Схема моноэтаноламиновой очистки от диоксида углерода / - абсорбер; 2- отпарная колонна, 3 - холодильник; 4.5 - теплообменник; 6 - сепаратор
Рис. 5.2. Схема моноэтаноламиновой очистки от диоксида углерода / - абсорбер; 2- отпарная колонна, 3 - холодильник; 4.5 - теплообменник; 6 - сепаратор
|
Цикл с разделением потоков раствора
Этот вариант позволяет снизить расход водяного пара. По данному варианту (рис. 5.3) выыходящий с низа абсорбера насыщенный раствор разделяется на два потока: один подается в верх отпарной колонны, второй - посредине ее высоты. Верхний поток движется навстречу парам, поднимающимся из кипятильника, и выводится из колонны выше точки ввода остальной части насыщенного раствора. Этот раствор регенерирован не полностью; он возвращается обратно в нижнюю секцию абсорбера для поглощения основной массы кислых газов. Часть раствора, поступающего посредине отпарной колонны, проходит через кипятильник, где почти полностью десорбируются кислые газы. Этот раствор возвращается в верх абсорбера для снижения содержания кислых газов до заданного уровня. При такой схеме количество паров, поднимающихся по колонне, несколько меньше, чем на установках, работающих при обычной схеме, отношение количеств жидкости и паров в обеих секциях отпарной колонны меньше, так как в каждую из них поступает лишь часть общего количества раствора.
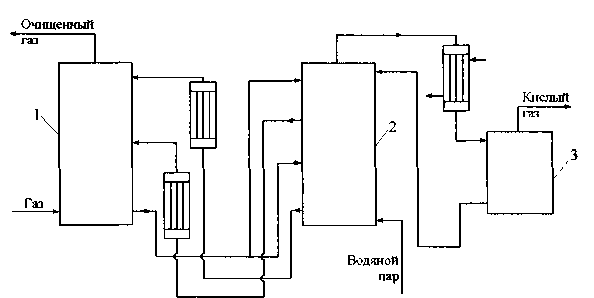 Рис.5.3. Схема моноэтаноламиновой очистки с разделением потоков раствора
/- абсорбер, 2 - отпарная колонна, 3 - сепаратор
Рис.5.3. Схема моноэтаноламиновой очистки с разделением потоков раствора
/- абсорбер, 2 - отпарная колонна, 3 - сепаратор
|
Недостатком варианта является увеличение капиталовложений на сооружение установки по сравнению с основной схемой.
5.2. Очистка газов от диоксида углерода адсорбцией
Адсорбционный метод применяется для тонкой очистки газов от' С02, необходимой в технологических установках с глубоким охлаждением, например, при промывке газа от оксида углерода жидким азотом в производстве аммиака, при разделении воздуха, коксового и др. газов.
Адсорбционный метод для дополнительной тонкой очистки газа можно применять после удаления основного количества С02 одним из известных методов.
В качестве адсорбентов могут применяться активированные угли и мелкопористый силикагель различных промышленных марок, а также синтетические цеолиты.
Предложен и экспериментально разработан адсорбционный способ тонкой очистки от С02 при низкой температуре. Способ состоит в том, что адсорбция С02 производится под давлением при температуре минус 40 - минус 50 °С, а десорбция - потоком инертного газа при низкой температуре и давлении, близком к атмосферному. Проведение адсорбции при пониженной температуре увеличивает поглотительную способность сорбента в несколько раз по сравнению с адсорбцией при обычной температуре. Затраты энергии незначительны и определяются только расходом на покрытие небольших дополнительных потерь холода и давления. При этом отсутствует постоянный расход какого-либо реагента. Агрегат очистки состоит из двух адсорберов, заполненных активированным углем и работающих поочередно (в одном - адсорбция, в другом - десорбция).
5.2.1. Очистка газов цеолитами
Цеолиты являются эффективными поглотителями С02 из различных промышленных газов. Молекулы С02 достаточно малы, что позволяет им проникать во внутреннюю структуру большинства цеолитов.
Примером применения цеолитов для одновременной осушки и очистки газов от примесей С02 является приготовление экзотермической контролируемой атмосферы (защитного инертного газа в металлургических процессах), получаемой при сгорании природного газа в воздухе. В результате сжигания метана получают азотоводородную смесь, насыщенную парами воды и содержащую до 12 % С02. Удаление примесей производят в установке с адсорберами, заполненными цеолитами. Обычно в этом процессе используют цеолиты марки СаА. Этот тип цеолита, наряду с высокими равновесными и кинетическими показателями, сохраняет свою стабильность при многоцикловой эксплуатации и в слабокислой среде. Характерной чертой этих установок является высокая концентрация извлекаемых примесей.
Схема опытно-промышленной установки, в которой нагрев цеолитов в стадии десорбции производится потоком горячего воздуха, представлена на рис. 5.4. Природный газ сжигается в газогенераторе I с небольшим недостатком воздуха. Продукты неполного сгорания, содержащие С02, после охлаждения в теплообменниках 3 и 4 и выделения влаги поступают в один из адсорберов 5, 6 или 7, заполненных цеолитом марки СаА, где происходит осушка газа и очистка его от С02. Регенерация цеолита производится нагретым в теплообменнике 3 воздухом, подаваемым вентилятором 2. Цеолиты на стадии регенерации нагревают до температуры не ниже 235 °С. Охлаждение их производится чистым газом, циркулирующим через систему и холодильник 8 при помощи газодувки 9, причем в начальный период охлаждения газ после продувки через цеолиты выбрасывается в атмосферу, а затем циркулирует в замкнутом контуре с постоянной подпиткой свежим газом.
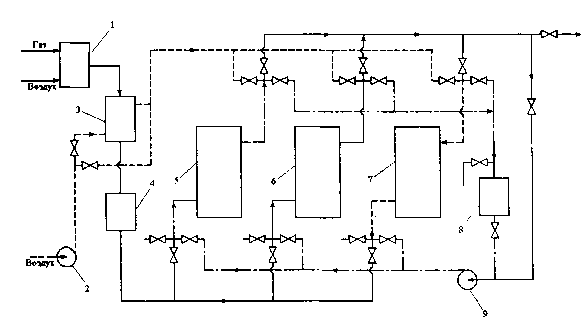 Рис. 5.4. Схема установки для приготовления очищенной экзотермической атмосферы с регенерацией цеолитов горячим воздухом / - газогенератор; 2 - вентилятор; 5 - газовоздушный теплообменник; 4. 8 - водяные холодильники; 5-7 - адсорберы на стадиях охлаждения, очистки и регенерации соответственно; 9 - циркуляционная газодувка
Рис. 5.4. Схема установки для приготовления очищенной экзотермической атмосферы с регенерацией цеолитов горячим воздухом / - газогенератор; 2 - вентилятор; 5 - газовоздушный теплообменник; 4. 8 - водяные холодильники; 5-7 - адсорберы на стадиях охлаждения, очистки и регенерации соответственно; 9 - циркуляционная газодувка
|
Другим процессом, получившим широкое распространение в промышленности, является подготовка воздуха к низкотемпературному разделению, т.е. осушка с одновременным удалением микропримеси С02.
При помощи цеолитов успешно решается ряд других задач: извлечение С02 из природного газа, удаление продуктов жизнедеятельности, в первую очередь влаги и С02, в современных изолированных экологических системах (например, космических кораблях) и т.д.
Системы жизнеобеспечения космических кораблей, включая блоки очистки газов, должна удовлетворять ряду дополнительных требований: отличаться минимальной массой, низким уровнем шума, максимальной надежностью и простотой в эксплуатации, не выделять в пространство замкнутой экологической системы токсических соединений.
Цеолитовые установки удаления С02, выделяемого в пространство космонавтами, перспективны для полетов средней продолжительности, когда десорбция поглощенного С02 может производиться непосредственно в вакуум космического пространства. Для длительных полетов создают системы с замкнутым круговоротом веществ в герметической кабине - использованием всех отходов жизнедеятельности человека, В этих условиях С02 является источником получения кислорода. Одновременно с С02 из кабины корабля должны выводится вредные токсичные примеси: УВ, спирты, кетоны, альдегиды, меркаптаны, органические кислоты. Эта задача решается при помощи активных углей.
ГЛАВА 6. ОЧИСТКА ГАЗОВ ОТ ОКСИДА УГЛЕРОДА
Оксид углерода (карбоксид) представляет собой высокотоксичный газ. Установлены жесткие предельно допустимые его концентрации: в рабочей зоне - 20 мг/м3, в атмосфере (максимально-разовая) - 5 мг/м3, среднесуточная - 3 мг/м3.
Оксид углерода СО образуется в результате неполного сгорания жидкого, твердого и газообразного топлива. Он входит в состав газов, выделяющихся в процессах выплавки и переработки черных и цветных металлов, выхлопных газов двигателей внутреннего сгорания, газов, образующихся при взрывных работах.
Методы санитарной очистки выбросов от оксида углерода дороги и несовершенны. Это не позволяет подвергать санитарной очистке значительные объемы выбросов, содержащих СО.
Чаще выполняют очистку газов от СО в технологических целях: например, газы, подаваемые на синтез аммиака, должны содержать не более 5-10 промилей СО, который является каталитическим ядом.
6.1. Каталитическая очистка газов от оксида углерода
Каталитическое окисление является наиболее рациональным методом обезвреживания отходящих газов промышленности от оксида углерода. Однако наряду с оксидом углерода в зависимости от условий конкретного производства в газах могут содержаться и другие токсичные компоненты: диоксид серы, оксиды азота, пары различных углеводородов. Кроме того, в них обычно присутствуют диоксид углерода, кислород, азот, пары воды и часто механические примеси в виде различных пылей. Некоторые из этих примесей могут быть ядами для катализаторов.
Процесс очистки газовых смесей с высоким содержанием СО осуществляется с использованием реакции водяного газа (конверсией с водяным паром), проводимой в присутствии окисных железных катализаторов:
СО + Н20 = С02 + Н2 + 37,5 кДж/моль.
Процесс применим для очистки водорода, получаемого конверсией природного газа, кроме того, метод используют для изменения соотношения Н2: СО в синтез-газе, а также для очистки защитной атмосферы, предназначенной для термообработки металлов.
Промышленный катализатор конверсии имеет форму таблеток размером 6,4x6,4 или 9,6x9,6 мм. Он содержит от 70 до 85 % Fe203 и 5- 15 % промотора Сг203. Катализатор относительно устойчив в присутствии сернистых соединений при непродолжительном воздействии капельной влаги; он сохраняет активность вплоть до 600 °С. В случае высоких концентраций СО в исходном газе катализатор в контакторе располагают в несколько слоев, причем необходимо предусмотреть меры для отвода тепла между слоями. Схема процесса представлена на рис. 6.1.
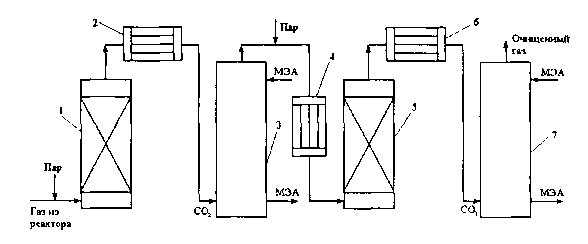 Рис. 6.1. Схема установки для очистки газов от оксида углерода реакцией водяного газа
I - конвертор СО первой ступени; 2,6- холодильники; 3 - абсорбер СО2 первой ступени; 4 - нагреватель газа; 5 - конвертор СО второй ступени; 7 - абсорбер СОг второй ступени
Рис. 6.1. Схема установки для очистки газов от оксида углерода реакцией водяного газа
I - конвертор СО первой ступени; 2,6- холодильники; 3 - абсорбер СО2 первой ступени; 4 - нагреватель газа; 5 - конвертор СО второй ступени; 7 - абсорбер СОг второй ступени
|
Газовую смесь, образованную в результате конверсии природного газа с паром и содержащую водород, оксид и диоксид углерода, после выхода из реактора конверсии охлаждают добавкой водяного пара до 370° и пропускают через конвертор первой ступени 1. Здесь в присутствии катализатора 90-95 % СО превращается в С02 с образованием эквивалентного количества водорода. Газ охлаждают в водяном холодильнике 2 до 35-40 °С и извлекают из него диоксид углерода этанола- мином. Очищенный газ подогревают, добавляют необходимое количество водяного пара, снова подвергают конверсии и очистке от образовавшегося С02. С целью получения водорода повышенной чистоты иногда процесс проводят в три ступени. После третьей ступени газ имеет состав: 99,7 % (об.) Н2; 0,02 % СО; 0,01 % С02; 0,27 % СН4.
Каталитические гидрирование оксида и диоксида углеродов в метан обычно применяется для очистки небольших остаточных количеств этих соединений (не более 2 %) в газовых потоках после удаления основной массы их при помощи других методов. Метод используется особенно часто в тех случаях, когда присутствие метана не ухудшает условий дальнейшей переработки или использования газов. Типичным примером применения этого процесса может быть удаление оксидов углерода из водорода после конверсии СО и абсорбции С02 жидкостными процессами. Остаточное содержание оксидов углерода в очищенном газе составляет несколько десятитысячных долей процента. Одновременно происходит удаление свободного кислорода, если он присутствует в газе.
Реакция метанирования оксидов углерода:
СО + ЗН2 = СН4 + Н20 + 218 кДж/моль;
С02 + 4Н2 = СН4 + 2Н20 + 180 кДж/моль.
Промышленный катализатор содержит 76-78 % NiO и 20-22 %
 Рис. 6.2. Схема установки для очистки газа метанированием
1 - теплообменник; 2 - холодильник; 3 - печь;
4 - реактор
Рис. 6.2. Схема установки для очистки газа метанированием
1 - теплообменник; 2 - холодильник; 3 - печь;
4 - реактор
|
А1203. Его изготовляют, как и в предыдущем случае, в виде таблеток. Срок службы катализаторов достигает несколько лет.
Схема установки представлена на рис. 6.2.
Газ после колонны этаноламиновой очистки от С02 подогревается сначала в теплообменнике теплом продуктов метанирования, а затем до 260- 270 °С в печи. Нагретый газ сверху вниз проходит через слой катализатора, охлаждается в теплообменнике и в концевом холодильнике, после чего поступает на синтез аммиака или используется для других целей. Вследствие неблагоприятного воздействия высоких температур на равновесие реакции и стабильность работы катализатора режим работы в реакторе регулируют таким образом, чтобы температура газа на выходе из реактора не превышала 440 °С. Процесс отличается высокой экзотермичностью: повышение температуры в реакторе составляет 56 °С на каждый процент карбоксида, содержащийся в газе. Это препятствует использованию данного процесса применительно к газам, содержащим более 2 % кислорода, оксида и диоксида углерода в сумме.
Метанирование проводят в широком интервале давлений - от атмосферного до 80 МПа (800 кгс/см2) и более. Степень очистки увеличивается с повышением давления.
6.2. Абсорбционная очистка газов от оксида углерода
В качестве абсорбента для поглощения СО применяют медноаммиачные растворы (МАР). В процессе абсорбции СО под высоким давлением поглощается в противоточном абсорбере раствором комплексного медно-аммиачного соединения. Чаще других используются растворы формиата, карбоната или ацетата меди. Раствор имеет слабощелочной характер, вследствие чего одновременно поглощается и диоксид углерода. Регенерацию проводят нагревом, под действием тепла комплекс разлагается и оксиды углерода полностью выделяются.
В абсорбере протекают следующие основные реакции:
[Cu(NH3)2]+ + СО + NH3 = [Cu(NH3)3CO]+;
2NH4OH + С02 = (NH4)2C03 + Н20;
(NH4)2C03 + С02 + Н20 = 2NH4HC03.
Ионы двухвалентной меди не могут связывать оксид углерода, но их присутствие (до 20 %) необходимо, т.к. они препятствуют выпадению металлической меди:
2Си+ → Сu + Сu++.
Степень очистки зависит от парциального давления СО над регенерированным раствором и общего давления газа.
Чтобы улучшить условия очистки, абсорбцию проводят при высоком давлении - 32 МПа и низкой температуре - около 0 °С. Десорбцию ведут при атмосферном давлении и температуре около 60 °С. Более высокие температуры приводят к интенсивному выделению аммиака. Схема установки приведена на рис. 6.3.
Газ из цеха компрессии под давлением 32 МПа поступает в скрубберы, орошаемые МАР.
Состав азотводородной смеси (%): Н2 70; N2 23-26; СО 3-5; СО2
1,5-2.
После очистки газ, содержащий не более 40 см3/м3 СО и до 150 см /м С02, подается в скрубберы, орошаемые аммиачной водой (на схеме не показан), где он освобождается от остальной С02, и затем в цех синтеза NH3. Регенерацию МАР проводят путем снижения Р и нагревания раствора в 6. В результате предварительного дросселирования МАР до 0,8 МПа из него удаляются растворенные Н2 и N2. При дальнейшем дросселировании до 0,1 МПа и нагревании раствора до 45-50 °С происходит разложение медноаммиачного комплекса и выделение СО.
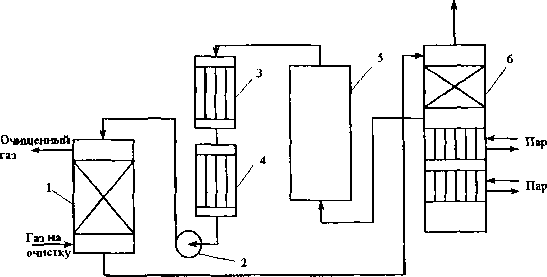 Рис. 6.3. Схема установки медно-аммиачной очистки газов / - абсорбер; 2 - насос; 3 - водяной холодильник; 4 - аммиачный холодильник 5 - емкость; 6 - десорбер
Рис. 6.3. Схема установки медно-аммиачной очистки газов / - абсорбер; 2 - насос; 3 - водяной холодильник; 4 - аммиачный холодильник 5 - емкость; 6 - десорбер
|
Для нагревания отработанного раствора до 60 °С служит отходящий регенерированный раствор, а для окончательного нагрева до 80 °С - пар. Регенерированный раствор охлаждают последовательно поступающим отработанным раствором, оборотной водой в теплообменнике 3 и испаряющимся жидким NH3 в холодильнике 4, после чего регенерированный раствор при 10 °С направляют на абсорбцию. В случае необходимости проводят окисление Си+ продуванием воздуха через регенерированный раствор.
Для разложения углекислого аммония при атмосферном давлении раствор нагревают не выше 80 °С. Поскольку при более высокой температуре медноаммиачный комплекс разлагается, для более полной регенерации вторую ее ступень проводят в вакууме.
Чтобы предупредить выделение металлической меди при регенерации аммиачного раствора формиата или ацетата меди, к нему добавляют свежую муравьиную или уксусную кислоту.
Окончательную очистку водорода, идущего на синтез аммиака, от оксида углерода производят промывкой газа жидким азотом при температуре порядка -190 °С под давлением 20-25 атм. Этот метод относится к низкотемпературным процессам очистки газов и основан на физической абсорбции СО.
Процесс очистки состоит из трех стадий: предварительного охлаждения и сушки исходных газов; глубокого охлаждения этих газов и частичной конденсации их компонентов; отмывки газов от оксида углерода, метана и кислорода жидким азотом в промывной колонне. Холод, необходимый для создания в установке низких температур, обеспечивается аммиачным холодильным циклом, а также рекуперацией холода обратных потоков азотноводородной фракции и азотного цикла высокого давления.
Характерным для этого процесса является отсутствие стадии десорбции поглощенной примеси из абсорбента: часть испарившегося азота примешивается к водороду и используется в ступени синтеза. Т.к. промывка ведется чистым абсорбентом, то может быть достигнута любая степень очистки.
Особенность процесса такова, что его можно рассматривать не как абсорбцию, а как ректификацию смеси N2 - СО в токе инертного газа - водорода.
Имеются данные о равновесии в тройной системе H2-N2-CO, анализ которых показывает, что Н2 практически не влияет на растворимость СО в жидком азоте. Поэтому расчет процесса можно проводить по данным для двойной смеси. Полученная по этим данным зависимость растворимости СО в жидком азоте от давления СО над раствором описывается законом Генри.
Минимальный расход азота для промывки 150м3 газа, содержащего 6 % СО возможен при Р = 2-2,6 МПа и равен 12-13 см3.
Температура оказывает очень большое влияние на расход жидкого азота и на высоту колонны.
Расход азота, как и для других процессов физической абсорбции, практически не зависит от концентрации СО и уменьшается почти пропорционально увеличению общего давления.
ГЛАВА 7. ОЧИСТКА ГАЗОВ ОТ СЕРОВОДОРОДА И СЕРООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Сероводород (H2S) и сероорганические соединения (СОС) образуются при переработке газов, вызывают отравление катализаторов, Ухудшение качества продукции, коррозию аппаратуры и загрязнение атмосферы.
В состав органической серы чаще всего входят сероуглерод (CS2), сероокись углерода (COS), тиофен, меркаптаны и сульфиды.
Проведение глубокой очистки от H2S и СОС рекомендуется на возможно более ранней стадии обработки газа. Выбор способа очистки обусловлен составом и свойствами газов, требованиями к степени очистки.
Очистка газов от H2S и СОС осуществляется в двух направлениях:
1. Санитарная очистка отходящих производственных и вентиляционных газов.
2. Очистка природных, коксовых и других промышленных газов, используемых в качестве сырья для синтеза, а также газов, образующихся на разных ступенях технологической нитки химических и нефтехимических производств. В этом случае решаются параллельно две задачи. С одной стороны, яд для каталитических процессов - H2S выводится из схемы и, как правило, перерабатывается в товарные продукты: серу, сернистый ангидрид, серную кислоту. С другой стороны, удаление H2S и СОС снижает или даже ликвидирует выброс в атмосферу диоксида серы, образующегося на окислительных стадиях химического процесса.
Все горючие газы, содержащие H2S, должны подвергаться очистке от него. К таким газам, кроме природного и коксового, относятся все газы нефтепереработки (крекинга, риформинга, гидроочистки и т.д.), генераторный, сланцепереработки.
При выборе метода очистки от H2S нужно всегда иметь в виду присутствие в газе другого “кислого” компонента - диоксиду углерода (С02). С технико-экономической точки зрения удалять С02 частично или полностью не всегда целесообразно. Но тогда поглотитель H2S должен обладать высокой избирательностью сорбции основного целевого компонента (H2S) в присутствии С02.
Требования к степени очистки от H2S - разные, в зависимости от назначения газа. Для природного и других газов, предназначенных для транспорта по магистральным газопроводам и для бытовых целей предельно допустимое содержание H2S составляет 0,02 г/м3, в газе для производства обычной мартеновской стали допускается 2-3 г/м3, а для химического синтеза, в зависимости от процесса, от 1 до 50 мг/м3.
ПДК рабочей зоны 10 мг/м3. Максимальная разовая и среднесуточная ПДК в атмосферном воздухе равны 0,008 мг/м3.
H2S, уловленный из газов, в зависимости от метода очистки, выделяется в виде элементарной серы или концентрированного газа, который каталитически перерабатывается в серную кислоту и элементарную серу. По технико-экономическим соображениям H2S более целесообразно перерабатывать в элементарную серу (ЭС), которая является дефицитным продуктом, примерно одну треть которого получают именно из газа (газовая сера).
Одним из основных методов сероочистки газов, который был описан ранее применительно к технологии очистки газов от диоксида углерода, является этаноламиновый метод. В равной степени, как указывалось, этот метод решает задачу очистки газов от сернистых соединений.
7.1. ФИЗИЧЕСКАЯ АБСОРБЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
Как было указано ранее, процессы очистки от “кислых” газов, основанные на абсорбции хемосорбентами, и в первую очередь растворами МЭА, имеют принципиальный недостаток, заключающийся в том, что расход тепла на отпарку увеличивается с повышением концентрации “кислых” газов! Растворимость С02 и H2S в этих растворах с ростом парциального давления обычно возрастает медленнее.
В современных схемах синтеза аммиака и ряде других схем газ поступает на очистку под давлением до 2,94 МПа (30 кгс/см2). В этих условиях эффективны процессы физической абсорбции органическими растворителями, что позволяет проводить их регенерацию без нагрева путем только снижения парциального давления кислых газов.
«Флюор» - процесс
Фирма “Флюор” разработала промышленный процесс, основанный на применении органических растворителей, имеющих в области высоких температур весьма низкое давление пара. В качестве абсорбентов применяют пропиленкарбонат (запатентованы также триацетат глицерина, бутоксидиэтиленгликольацетат и метокситриэтиленгли- кольацетат).
Основное преимущество «Флюор» - процесса заключается в том, что десорбция кислых газов происходит только за счет снижения давления, поэтому энергия расходуется в основном только на перекачивание абсорбента. Такой способ десорбции может быть осуществлен лишь при достаточно высоком давлении кислых газов в очищаемом газе. Так, при очистке газа, содержащего только С02, процесс экономичен при парциальном давлении С02 в исходном газе, превышающем 3,92.105-6,86.105 Па (4-7 кгс/см2). При очистке от H2S, а также при совместной очистке от С02 и H2S «Флюор» - процесс экономичен и при более низких парциальных давлениях.
Технологическая схема процесса по существу не отличается от схемы водной очистки газов от диоксида углерода.
Процесс «Пуризол»
Другим способом физической абсорбции С02 и H2S является процесс «Пуризол», принципиально не отличающийся от «Флюор» - процесса. В качестве абсорбента используется N-метилпирролидон (NMP) - растворитель, нашедший широкое применение для выделения ацетилена из газов окислительного пиролиза метана.
NMP является хорошим абсорбентом при очистке газов от меркаптанов благодаря высокой поглотительной способности и одновременной возможности легкой регенерации (вследствие более резкой зависимости растворимости меркаптанов от температуры).
NMP можно применять для избирательной очистки газов от H2S, т.к. его растворимость в данном абсорбенте существенно отличается от растворимости С02.
К другим преимуществам NMP следует отнести полное отсутствие агрессивных свойств, нетоксичность и легкую биологическую раз- лагаемость (в случае попадания в сточные воды).
Недостатком процесса, как и всех процессов физической абсорбции, является то, что при высоком давлении газа в раствор переходят большие количества углеводородных компонентов (метан и пр.), что неизбежно влияет на растворимость H2S и С02.
В процессе «Пуризол» и других аналогичных процессах часть раствора непрерывно отводят на ректификацию вместе с промывными водами, образующимися при промывке отходящих газовых потоков водой с целью снижения потерь растворителя. Для уменьшения расхода тепла на ректификацию и потерь растворителя, очищаемый газ подвергают предварительной осушке в том же абсорбере.
Процесс «Селексол»
В качестве абсорбента применяют диметиловый эфир полиэти- ленгликоля. Для абсорбента характерна высокая селективность при извлечении H2S (растворимость H2S в 7 раз выше растворимости С02). Поглотительная способность растворителя по отношению к органическим сернистым соединениям тоже велика.
Процесс «Сульфинол»
Разработан для очистки природных и нефтяных газов от H2S и С02. Процесс отличается применением смешанного поглотителя сульфинол, состоящего из алканоламина (в частности диизопропаноламина) и сульфолана (тетрагидротиофендиоксида).
Важным преимуществом процесса является возможность переключения на данный поглотитель действующих установок аминовой очистки.
Схема процесса принципиально совпадает с обычной схемой очистки растворами аминов.
Преимуществом процесса является уменьшение интенсивности циркуляции и расхода тепла по сравнению с обычными процессами очистки аминами. Кроме того, сульфинол одновременно с H2S и С02 удаляет низшие меркаптаны и сероокись углерода, содержащиеся во многих природных газах.
Скорость коррозии даже в узлах с наиболее тяжелыми условиями не превышает 0,025 мм в год. Вспенивание поглотителя в абсорбере и регенераторе полностью отсутствует. Тепловая нагрузка при очистке процессом сульфинол меньше, чем при зтаноламиновой очистке.
7.2. Окислительные методы очистки газов от сероводорода
Химизм удаления H2S из газов окислительными процессами с получением элементной серы может быть схематически представлен уравнением:
2H2S + 02→ 2S + 2Н20.
Однако при обычных температурах скорость этой реакции слишком мала для возможности использовать ее в практическом процессе сероочистки. Проведение процесса при сравнительно высоких температурах предпочтительно в присутствии катализаторов или с применением промежуточных переносчиков кислорода, легко взаимодействующих с сернистыми соединениями при обычных температурах, позволяет достигнуть достаточно высоких скоростей окисления. Такие переносчики кислорода применяются в сухом состоянии или в виде добавок к жидким растворителям и долж
Дата добавления: 2016-12-27; просмотров: 11144;











