Лекция № 23. Элементы IIIA-подгруппы
Элементы IIIA-подгруппы: бор - B, алюминий - Al, галлий - Ga, индий - In и таллий - Tl. Общая электронная формула их атомов - ns2np1 - обуславливает образование этими элементами соединений в степени окисления +3. С увеличением порядкового номера наряду с данной степенью окисления становится возможным проявление степени окисления +1. Для таллия степень окисления +1 наиболее характерна за счет устойчивости конфигурации 6s2.
Увеличение эффективного атомного радиуса и уменьшение электроотрицательности при переходе от бора к таллию приводит к нарастанию металлических свойств простых веществ. Так бор - неметалл, алюминий - активный металл, соединения которого проявляют амфотерные свойства, а таллий - активный, напоминающий щелочные, металл.
23.1. Бор и его соединения
Бор - довольно распространенный элемент земной коры (кларк 6×10-4 мол.%), представлен в природе двумя изотопами: 10B (20%) и 11B (80%). Основные минералы: бура - Na2B4O7×10H2O, кернит - Na2B4O7×7H2O, сасолин - H3BO3.
Элемент бор образует несколько аллотропных модификаций, в основе которых лежит группировка B12 в форме правильного двадцатигранника - икосаэдра. Модификации отличаются способом связывания икосаэдров друг с другом. Кристаллы бора черного цвета, тугоплавки (т.пл. 2300 °С), обладают полупроводниковыми свойствами.

Получают бор, восстанавливая его активными металлами из соединений, или пиролизом бороводородов:
t t
B2O3 + 3Mg = 3MgО + 2B; NaBF4 + 3Na = 4NaF + B
t
B2H6 = 2B + 3H2
Химические свойства. Бор - химически инертное вещество. При обычных условиях реагирует только со фтором:
2B + 3F2 = 2BF3
При нагревании до 400 - 700 °С реагирует с другими неметаллами и активными металлами:
t t t
4B + 3O2 = 2B2O3; 2B + 3S = B2S3; 2B + N2 = 2BN;
оксид бора сульфид бора нитрид бора
t t
4B + C = B4C; Mg + 2B = MgB2
карбид бора борид магния
Бор обладает очень высоким сродством к кислороду, поэтому энергично реагирует с многими оксидами:
t
4B + 3SiO2 = 3Si + 2B2O3
С водой бор не реагирует, но окисляется концентрированной серной и азотной кислотами, щелочи растворяют бор только в присутствии окислителей.
t
B + 3HNO3 = H3BO3 + 3NO2
Основная область применения бора - атомная энергетика. Изотоп 10B имеет очень большое сечение захвата нейтронов. По поглощающей способности слой бора-10 толщиной 1 см эквивалентен 20 см свинца или 5 м бетона. В то же время изотоп 11B один из самых прозрачных для нейтронов материалов. Значительное количество бора идет на легирование сплавов, которым он придает твердость и коррозионную устойчивость.
Соединения бора
Важнейшими соединениями бора являются гидриды, галогениды, оксид, борные кислоты и их соли.
Простейший гидрид бора - BH3 - не существует, поскольку атом бора в данной молекуле должен содержать на внешнем уровне шесть электронов вместо восьми (завершенные электронный уровень). Электронодефицитность бора компенсируется за счет образования мостиковых связей с атомом водорода.
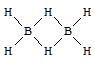
В молекулах других бороводородов наряду с мостиковыми и терминальными (концевыми) связями бор - водород образуются связи бор - бор, что приводит к образованию более сложных структур.
Обычным методом получения бороводородов (боранов) является гидролиз боридов металлов, например:
6MgB2 + 12HCl = B4H10 + 8B + 6MgCl2 + H2
Бороводороды - высокореакционноспособные вещества, на воздухе горят, многие самовоспламеняются, разлагаются водой:
B2H6 + 3O2 = B2O3 + 3H2O
B2H6 + 6H2O = 2H3BO3 + 6H2
Бороводороды и органические соединения бора широко применяются в качестве ракетного топлива.
Галогениды бора, особенно фторид - BF3, сильнейшие акцепторы электронов (кислоты Льюиса), легко реагируют с донорами электронной пары, сильно гидролизуются:
BF3 + KF = KBF4; BF3 + :NH3 = F3B:NH3
тетрафтороборат калия
BF3 + 3H2O = H3BO3 + 3HF
Оксид бора - B2O3 - бесцветная хрупкая стеклообразная масса, кислотный оксид, энергично присоединяет воду с образованием борной кислоты:
B2O3 + 3H2O = 2H3BO3
Получается борная кислота также при действии сильных кислот на тетрабораты:
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H3BO3
H3BO3 - очень слабая кислота, причем ее кислотность проявляется не за счет отщепления катиона водорода, а за счет связывания гидроксид-аниона:
H3BO3 + H2O  H+ + [B(OH)4]-
H+ + [B(OH)4]-
При взаимодействии со щелочами образует тетрабораты - соли гипотетической тетраборной кислоты:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O
При нагревании борная кислота ступенчато теряет воду, образуя вначале метаборную кислоту, а затем оксид бора:
t t
H3BO3 ¾® HBO2 ¾® B2O3
Нитрид бора получается прямым взаимодействием простых веществ и существует в двух модификациях: графито- и алмазоподобной (эльбор), имеющей кубическую кристаллическую решетку. Эльбор - очень твердый материал, некоторые его образцы царапают алмаз. При этом он термически устойчив до 2000 °С.
23.2. Алюминий и его соединения
Алюминий - один из наиболее распространенных элементов земной коры (кларк составляет 6,6 мол.%). Основные минералы: Al2O3 - корунд (окрашенные модификации - рубин, сапфир), Al2O3×nH2O - боксит, Na3AlF6 - криолит. Значительное количество алюминия находится в земной коре в виде алюмосиликатов.
Алюминий - серебристо-белый металл с высокой электро- и теплопроводностью, очень легкий (плотность 2,7 г/см3). Широко применяется в электротехнике, по электропроводности уступает только золоту, серебру и меди. Пластичен, хорошо обрабатывается прессованием и ковкой. Сплавы алюминия: силумины (11-14% кремния), дюралюмины (3,5-4% меди, 0,5-1% магния, кремния и марганца), магналий (3-30% магния) отличаются высокой прочностью и легкостью, что делает их основными конструкционными материалами в самолето- и ракетостроении.
В промышленности алюминий получают электролизом глинозема (технический оксид алюминия), растворенного в расплаве криолита Na3AlF6. В расплаве Al2O3 ведет себя как электролит.
Al2O3 = Al3+ + AlO33-
Катод: Al3+ + 3e- = Al
Анод: 4AlO33- - 12e- = 2Al2O3 + 3O2
Алюминий - очень активный металл, по активности уступает только щелочным и щелочноземельным металлам. Однако прочная оксидная пленка на поверхности алюминия придает ему повышенную устойчивость в обычных условиях. Если оксидную пленку удалить, алюминий активно реагирует с водой и кислородом воздуха:
4Al + 3O2 = 2Al2O3
2Al + 6H2O = 2Al(OH)3 + 3H2
При высоких температурах оксидная пленка не защищает алюминий и металл энергично взаимодействует с кислородом, серой, галогенами, азотом, фосфором, углеродом, образуя соответствующие бинарные соединения. Высокое сродство алюминия к кислороду позволяет использовать его для восстановления металлов из их оксидов (алюмотермия):
t
Fe2O3 + 2Al = 2Fe + Al2O3
Алюминий легко растворяется в водных растворах щелочей и кислот, не обладающих окислительными свойствами:
2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2
2Al + 6HCl = 2AlCl3 + 3H2
Концентрированные кислоты-окислители и очень разбавленная азотная кислота пассивируют алюминий, взаимодействие возможно при нагревании:
t
8Al + 30HNO3 (разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
Дата добавления: 2017-10-04; просмотров: 2068;











