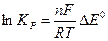Восстановительный потенциал
Для количественной характеристики окислительно-восстановительных реакций используются восстановительные потенциалы.
Стандартный восстановительный потенциал Е0 – это стандартная свободная энергия полуреакции, отнесенная к одному заряду электрона в полуреакции:
Ox + nē = Red 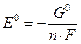
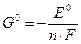 ,
,
где n – число электронов, участвующих в полуреакции, а F – постоянная Фарадея, равная заряду одного моля электронов, F ≈ 96500 Кл/моль.
В качестве точки отсчета принят потенциал стандартного водородного электрода (р = 1 атм, 2н H2SO4 ([H+] = 1 M), Pt):
H+ + ē = ½H2 E0 = 0 В
В приложении в таблице № 5 приведены величины остальных потенциалов для стандартного кислого ([H+] = 1 М, pH = 0) и для стандартного щелочного ([OH─] = 1 М, pH = 14) растворов.
В случае окислительно-восстановительной реакции критерием ее протекания является разница в стандартных восстановительных потенциалах окислителя и восстановителя. ∆E0 > 0 – реакция термодинамически возможна (∆G0 < 0):
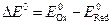
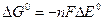
Чем больше значение E0, тем выше окислительная способность окисленной формы (находящейся в левой части полуреакции) и меньше восстановительная способность восстановленной формы (находящейся в правой части полуреакции), и наоборот. Таким образом, наиболее сильные окислители имеют высокое значение Е0, а наиболее сильные восстановители – низкое значение Е0.
Для определения направления протекания окислительно-восстановительной реакции так же удобно пользоваться правилом «Z». Для этого необходимо записать две стандартные полуреакции одну под другой, причем верхняя должна иметь меньшее значение E0. В этом случае восстановитель верхней полуреакции будет взаимодействовать с окислителем нижней, приводя к соответствующим продуктам ОВР:
Mn2+ + 2ē = Mn E0 = –1,18 В (Mn – восстановитель)

2H+ + 2ē = H2 E0 = 0 В (H+ – окислитель)
Mn + 2H+ = H2 + Mn2+ ∆E0 = 0 – (–1,18) = 1,18 В >0
Разница стандартных восстановительных потенциалов окислителя и восстановителя связаны с константой равновесия реакции:
|

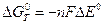
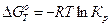
Стандартный восстановительный потенциал и потенциал при нестандартных условиях связаны между собой уравнением Нерста:
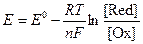 ,
,
где Е0 – стандартный восстановительный потенциал (В), R – универсальная газовая постоянная (8,31 Дж/моль∙К), T – температура (К), n – число электронов, участвующих в полуреакции, F – постоянная Фарадея, [Ox] и [Red] – молярные концентрации окисленной и восстановленной форм соответственно.
При T = 298 К уравнение Нерста принимает вид:
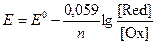
Например, для полуреакции
MnO42─ + 2H2O + 2ē → MnO2 + 4OH─
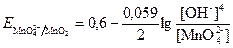
Этот потенциал зависит от рН раствора. Есть потенциалы, которые не зависят от рН раствора (в полуреакцию не входит вода, окислитель и восстановитель не менят формы существования в зависимости от среды), например Na+ + ē à Na.
Дата добавления: 2021-09-07; просмотров: 467;