ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ РН
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
Н2О 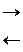 Н+ + ОН–
Н+ + ОН–
По величине электропроводности чистой воды можно вычислить концентрацию ионов Н+ и ОН– в воде. При Т = 25оС она равна 10–7 моль/л.
Напишем выражение для константы диссоциации воды:
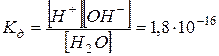
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде практически равна общей концентрации воды. Концентрацию молекул воды можно рассчитать, разделив массу 1 л воды на массу ее моля:
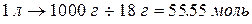
т.е. [H2O] = 55.56 моль/л.
Записав уравнение следующим образом, и подставив значения константы диссоциации и концентрации воды, получим значение для произведения концентраций ионов водорода и гидроксид ионов в воде – ионное произведение воды 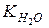 :
:
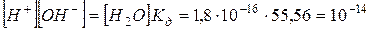
Получим выражение:
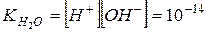
В чистой воде [H+] = [OH–] = 10–7
Видно, чтобы охарактеризовать реакцию среды любого водного раствора, достаточно указать лишь концентрацию ионов водорода H+ или гидроксид–ионов OH–. За такой показатель взята концентрация ионов H+.
Нейтральная среда
[H+] = [OH–] = 10–7
Кислая среда
[H+] > 10–7 > [OH–]
Щелочная среда
[H+] < 10–7 < [OH–]
Для удобства, концентрацию ионов водорода характеризуют водородным показателем воды рН.
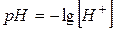
Водородный показатель – количественная характеристика среды.
pH = – lg [H+] [H+] = 10–7 pH = – lg 10–7 = 7 – нейтральная
[H+] = 10–3 pH = – lg 10–3 = 3 – кислая
[H+] = 10–11 pH = – lg 10–11 = 11 – щелочная
Запомним: в нейтральной среде рН = 7, в кислой рН < 7, в щелочной рН > 7. это можно представить в виде схемы:
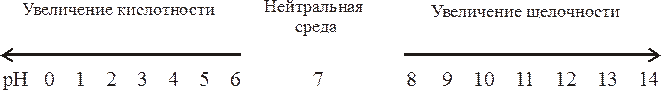
Гидроксильный показатель
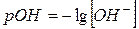
pOH = – lg [OH–] [ОH–] = 10–7 pОH = – lg 10–7 = 7 – нейтральная
[ОH–] = 10–4 pОH = – lg 10–4 = 4 – щелочная
[ОH–] = 10–12 pОH = – lg 10–12 = 12 – кислая
Реакция среды устанавливается с помощью индикатора. В качестве индикаторов чаще всего применяют вещества (как правило, это сложные органические красители), способные давать с одним из реагирующих веществ легко заметную цветную реакцию. В растворе происходит диссоциация индикатора, в результате которой образуется диссоциированная форма и не распавшаяся часть, которая в разных средах приобретает различную окраску (пример с фенолфталеином).
ГИДРОЛИЗ СОЛЕЙ
Взаимодействие соли с молекулами воды, в результате которого образуются кислота и (или кислая соль) и основание (или основная соль), называется гидролизом солей.
Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы Н+ и ОН–, но в процессе гидролиза один или оба из этих ионов могут «связываться» ионами подвергающейся гидролизу соли в малодиссоциированные, летучие или труднорастворимые вещества.
Характер протекания гидролиза зависит от природы солей. Все многообразие гидролиза можно свести к трем типам.
1. Гидролиз соли, образованной сильным основанием и слабой кислотой:
CH3COONa + H2O 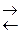 CH3COOH + NaOH
CH3COOH + NaOH
В результате гидролиза такой соли в растворе находится сильнодиссоциированное основание и слабодиссоциированная кислота. Следовательно, образуется больше гидроксоионов (т.к. ионы водорода выводятся из реакции) и раствор имеет щелочную реакцию.
Дата добавления: 2020-10-14; просмотров: 678;











