Кинетика хлорирующего обжига различного сырья
Кинетика хлоридовозгоночного обжига. Протекание хлоридовозгоночного обжига соединений тяжелых цветных и сопутствующих металлов в зависимости отосновных факторов (температура, концентрация и тип хлоринатора, состав газовой фазы, размер частиц и т.п.) изучено главным образом на порошкообразных или предварительно гранулированных материалах. В качестве основного критерия процесса служило остаточное содержание металла в огарках. Наиболее часто хлоринатором был газообразный Сl2. Наибольшее применение газообразный хлор нашел в металлургии титана при получении TiCl2. В ИМеТе Резниченко В.А. были проведены исследования кинетики хлорирования TiO2 хлором в присутствии углерода. Исследования проводили в температурном интервале 500-800 0С в течение 5-60 мин, со скоростью подачи хлора 18 л/мин. Результаты исследования приведены на рисунке 40 показывают, что при 800 0С хлорирование TiO2 завершается при 800 0С в течении 35 мин. Екаж процесса в начальный период составляет 8,8 кДж, а завершающего 3,98кДж. Процесс лимитируется сорбционными явлениями.
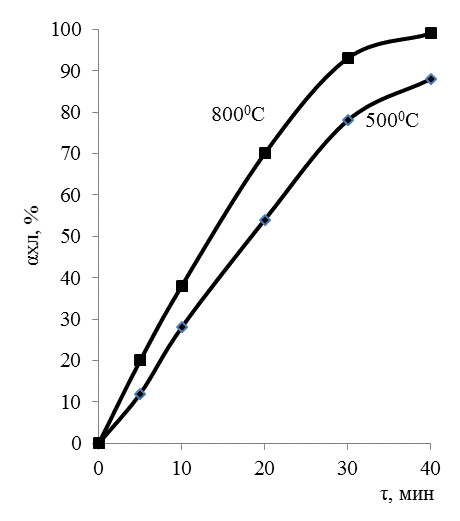
Рисунок 40. Влияние температуры и времени на хлорирование TiO2 в системах TiO2 - Cl2 –С
Механизм хлорирования оксидов металлов Сl в присутствии С изучен слабо. Из существующих воззрений на механизм хлорирования ТiO2 необходимо отметить следующее: 1) хлор взаимодействует с ТiO2 с образованием ТiС14 и O2, который затем взаимодействует с Сc образованием СО2 или СО (в зависимости от концентрации С и условий его взаимодействия с O2); 2) ТiO2 вначале восстанавливается С или СО до оксида низшей валентности: 4ТiO2 + С= 2Ті2O3 + С02; 6ТiO2 + С =2Ті3O5 + СO2. Указанные оксиды затем реагируют с Сl с образованием ТіСl4 или протекает реакция 2Ті3O3 + 2Сl2 = ТiС14 + 5ТiO2; 3) хлорирование ТiO2 осуществляется фосгеном, образующимся в результате взаимодействия Сl с оксидом С в присутствии угля: СО + Сl2 = СOСl2, ТiO2 + 2СОСl2 = ТіСl4 + 2СO2, СO2 + С = 2СО; 4) хлорирование осуществляется с помощью хлоруглеродов, образующихся на поверхности угля; 5) хлорирование протекает путем образования на промежуточной стадии радикалов, молекулы которых содержат O2.
При формировании оксидов Zn, Cu, Pb найдено, что между Екаж и ∆G0T имеется связь:
Екаж (Cu2O) = 304,5 - i/Rхл ∙ 105,5; (73)
Екаж (PbO) = 282,4 - i/Rхл ∙ 99,5; (74)
Екаж (ZnO) = 114,3 - i/Rхл ∙ 82,4 ∙ i Rхл; (75)
Екаж (CuO) = 320,2 - i/Rхл ∙ 144,9 ∙ i Rхл; (76)
Екаж (Cu2O) = 63,6 + ∆GT° ∙ 0,39; (77)
Екаж (PbO) = 70,4 + ∆GT° ∙ 0,45; (78)
Екаж (ZnO) = 20,2 + ∆GT° ∙0,16; (79)
Екаж (CuO) = 100,2 + ∆GT° ∙0,69; (80)
Екаж (MеО) = 36,2 + Jok ∙ 24,44 + ∆GT° (0,18 + Jok ∙ 0,2 (81)
где Jok - ионный потенциал катиона оксида, Rхл – радиус катиона хлорагента, ∆GT° - изменение энергии Гиббса хлорирования оксида, кДж/моль С12, i– заряд катиона хлорирующего агента.
Хлоридовозгонка ZnO в расплаве CaCl2 (способным распадаться на СаCl+ и Cl -) сопровождается образованием промежуточного комплекса [ZnO….Cl] - .При этом взаимодействие ZnO сCaCl2 происходит в следующей последовательности:
-закрепление Cl - на акцепторных центрах ZnO с образованием атомарного хлора (F + 2Cl - = 2Cl°);
- хемосорбция Cl° на донорных центрах (V0 + 2Cl° + e = 2Cl - адс+ 2V°0);
- диффузия Cl - адс по кислородным вакансиям поверхностного слоя и взаимодействие с ZnO.
(ZnxZn + Oxo + 2Cl - = ZnCl2 + O + 2e). (82)
Хлорирование PbO хлоридом кальция, при 1043 - 1473 К сопровождается образованием промежуточных соединений - оксохлоридов. Причем процесс развивается в сторону образования более кислого оксохлорида, т.е. по схеме:
PbO → 4PbO∙PbCl2→3PbO∙PbCl2→2PbO∙PbCl2→PbCl2 (83)
На последней стадии реакция протекает с участием ионов [Pb2O2Cl2]2 - и Pb2+.
Установлено, что на степень и скорость хлоридовозгонки CuO оказывают влияние температура, продолжительность хлорирования, количество и вид хлорирующих агентов, а также присутствие углерода и двуокиси кремния. Кинетика взаимодействия CuO с хлоридом натрия в области температур 1473 - 1573 К в начальный период контролируется кинетическим фактором и описывается уравнением первого порядка. Екаж этого периода составляет 64,06 ккал/моль. Далее процесс подчиняется уравнению Ротиняна - Дроздова, учитывающего влияние диффузионных сопротивлений на реакцию разложения хлористого натрия. При этом Екаж уменьшается до 41,27 ккал/моль. Аналогично, но с большей скоростью протекает взаимодействие CuO с хлоридом кальция. При подчинении процесса уравнению Колмогорова - Ерофеева «Екаж» начального периода составляет 26,82 ккал/моль, а конечного - 25,4 ккал/моль. Взаимодействие CuO с хлоридами натрия и кальция локализуется на границе раздела фаз окисел - хлорид. При этом химизм хлорирования состоит из ряда стадий: разложение окиси меди, образование активного молекулярного или атомарного хлора, хлорирование образованной закиси. Показано, что добавление раздельного угля и кремнезема к системам CuO - NaCl, CuO - CaCl2позволяет интенсифицировать перевод окисленной меди в хлоридную. При этом роль угля преимущественно сводится к увеличению концентрации образующегося хлора в зоне реакции, а кремнезем способствует разложению хлоридов Na и Cа. Взаимодействие оксида меди (II) с хлоридами натрия и кальция в присутствии смеси кремнезема и угля значительно ускоряется, а Екаж уменьшается. Для системы CuO - NaCl - C - SiO2 она равна 13,25 ккал/моль, а для системы CuO - CaCl2 - C - SiO2 - 6,1 ккал/моль.
Исследована кинетика хлоридовозгонки Cu, Zn и Pb из трех и четырехкомпонентных систем на основе Cu2O, PbO, ZnO, Fe2O3 при 1073 - 1473К из систем PbO - ZnO - Cu2O; PbO - ZnO - Fe2O3; Cu2O - PbO - Fe2O3; Cu2O - ZnO - Fe2O3; и ZnO - PbO - Cu2O - Fe2O3 [63,64]. Установлено явление интенсификации хлоридовозгонки Cu, Pb, Zn из поликомпонентных систем в сравнении с индивидуальным хлорированием, связанное с развитием сопряженных реакций, а именно: с участием в хлорировании свинца хлоридов Fe, Zn, Cu; меди - хлоридов Zn и Fe; цинка - хлорида железа.
Хлоридовозгонка Cu, Pb, Zn из систем ZnS - (CaCl2+NaCl), PbS - (CaCl2+NaCl), Cu2S - (CaCl2+NaCl) при 1173 - 1373К сопровождаются предварительным окислением сульфидов и выделением хлора. По убыванию реакционной способности сульфиды располагаются в ряд:PbS, ZnS, Cu2S. Причем Екаж в этом ряду увеличивается в следующей последовательности: 76,9;105,6; 121,8кДж/моль. Показано [63,65 ], что дефектность Cu2O, образующегося при окислении Cu2S в процессе его хлорирования хлором определяется выражением:
N2 = Kдеф∙[Pcl2/(P2CuCl∙P 0,5o2)]
гдеN - концентрация вакансии меди и электронных дырок;
Кдэф - константа равновесия квазихимического уравнения хлорирования Cu2O.
Увеличение N, а следовательно и реакционной способности, связано с уменьшением Po2 за счет образования CaSO4.
В системах MeS - Me’S - CaCl2 - O2 и MеS - Me’S - Me”S - CaCl2 - O2 хлоридовозгонка цветных металлов изменяется при 1179 - 1373 К следующим образом:
для Pb: (PbS - Cu2S - ZnS) > (PbS - Cu2S) > (PbS - ZnS);
для Cu: (PbS - Cu2S - ZnS) > (Cu2S - ZnS) > (Cu2S - PbS);
для Zn: (ZnS - Cu2S) > (ZnS - PbS) > (PbS - Cu2S - ZnS).
При этом Екаж для Pb изменяется от 54,8 до 58кДж/моль, для Cu от 65,1 до 89,6 кДж/моль и для Zn от 76,5 до 84,5кДж/моль. Ускорение хлоридовозгонки для металлов объясняется образованием в системах дополнительных, более активных (чем CaCl2) хлорирующих агентов. Например, в системах PbS - Cu2S - ZnS - CaCl2 - воздух образуются два дополнительных (для Pb) хлорирующих агента: CuCl и ZnCl2 [64,66].
В оксидно - сульфидных системах MeS - Me′S - CaCl2 - O2 хлоридовозгонка возрастает в следующих последовательностях:
Система PbS - MeO (по Pb):(PbS - ZnO) > (PbS - Cu2O) > (PbS - PbO);
Система ZnS - MeO (по Zn):(ZnS - ZnO) > (ZnS - Cu2O) > (ZnS - PbO);
Система CuS - MeO (Cu):(Cu2S - PbO) > (Cu2S - ZnO) > (Cu2S - Cu2O).
Применительно к переработке сырья в печи кипящего слоя в ГиниВЕТМЕТ (Зак М.С.) было исследовано влияние температуры и времени на хлоридовозгонку различного сырья. Результаты по хлоридовозгонке Cu, Zn, Pb, Ni и Co показали следующее:
Для всех металлов интенсивность процесса резко возрастает с ростом температуры. При температуре ниже 973°К для Zn, 1073°К для Си и 1153°К для Ni суммарный процесс хлоридовозгонки тормозится отгонкой в газовую фазу образующихся хлрридов этих металлов, причем особенно велико количество неотогнанных хлоридов в начальный период. При превышении указанных температур скорость отгонки хлоридов выше скорости их образования и не лимитирует протекание процесса. Хлоридовозгонка металлов из всех изученных образцов сырья при температурах 1073- 1273°К протекает: Cu - в диффузионной или переходной области с кажущейся энергией активации Eкаж- 15-50 кдж/моль, Zn и Pb - в переходной и кинетической = 70-110 кLж/
моль. Макрокинетика хлоридовозгонки этих металлов существенно зависит от состава газовой фазы и структуры частиц. Реакции собственно хлорирования в значительной степени предшествуют реакции окислении остаточных сульфидов и разложения ферритов Сu и Zn и силикатов Zn и PC . Хлоридовозгонка Ni при температурах 1273-1423°К протекает в начальный период времени в переходной области ( Екаж=50 кДж/моль), а затем в диффузионной - Екаж = 30 кдж/моль, Со - в интервале 1173- 1423°К в переходной области, Екаж - 50 кдж/моль. Суммарный процесс хлоридовозгонки Sn из природного касситерита в восстановительной среде при температурах 1113-1273°K протекает, в зависимости от состава газовой фазы в переходной (Екаж = 50 кДж/моль) или в кинетической области (Екаж=87кДж/моль). Последняя характерна для среды с высоким восстановительным потенциалом. Это служит подтверждением первичности реакции восстановления касситерита.
Дата добавления: 2017-06-13; просмотров: 2052;











