Сущность хлорирующего обжига. Термодинамика процесса.
Основой хлорирующего обжига является хлорирование металлов, оксидов, сульфидов, сульфатов, силикатов и других веществ с хлором и хлорсодержащими соединениями по реакциям, в результате которых образуются хлориды. При низкотемпературном обжиге образующиеся хлориды металлов остаются в огарке, а при высокотемпературном – переходят в газовую фазу (хлоридовозгонка). В присутствии кислорода обжиг называется окислительно-хлорирующий, а в присутствии восстановителя- хлорирующий-восстановительный (или восстановительно-хлорирующий).
Основные реакции собственно хлорирования простых соединений:
МеО+Cl2=MeCl2+0.5O2 (54)
MeO+Cl2+C=MeCl2+CO (55)
MeO+2HCl=MeCl2+H2O (56)
MeO+Me’Cl2=MeCl2 +Me’O (57)
MeS+Cl2=MeCl2+0.5S2 (58)
MeS+2HCl=MeCl2+H2S (59)
MeS+Me’Cl2=MeCl2+Me’S (60)
MeS+Me’Cl2+2O2=Me’Cl2+МеSO4 (61)
Возможность протекания реакций (54, 55, 56) определяется из выражения:
∆G(1)= ∆G’MeCl2-∆GMeO (62)
при ∆G(1) <0 равновесие реакции смещено вправо, при ∆G(1) >0- смещено влево. По данным Коршунова Б. Г. (МИСиС) величине и знаку ∆G0Т, ккал/мольCl2 хлорированные хлором при 1273 К оксиды располагаются в ряд: PbO (-25), Cu2O (-23.7), ZnO (-17.6), SnO (-16,6), MnO (-9.9), FeO(-5.2), CuO (-2.1), MgO (+6.2), Al2O3 (+9.4), TiO2 (+15.9), SiO2 (21.4).
В присутствии углерода равновесие реакции (1) смещается вправо и большинство оксидов хлорируется до конца. Сточки зрения термодинамики роль углерода объясняются однозначно, поскольку взаимодействие углерода с кислородом характеризуется большим отрицательным значением ∆G0Т.
Возможность хлорирования оксидов хлоридом водорода по реакции 2 определяется выражением:
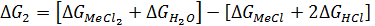 (63)
(63)
Или
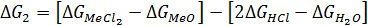 (64)
(64)
Т.е.если разница между сродством 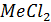 и
и 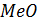 больше разницы между сродством 2
больше разницы между сродством 2 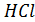 и
и 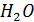 тогда равновесие реакции смещено вправо. Расчеты выполненные комплексом HSC-5.1 показывают, что при 1273 К оксиды по ∆G0Т, ккал/мольCl2 взаимодействия с HCl располагается в ряд : Cu2O (-17.13), PbO (-17.04), CdO(-13.85), ZnO(+0.57), FeO(+1.89), CuO(+4.5), NiO(+8.29), SiO2(28.96), Al2O3(+51.3).
тогда равновесие реакции смещено вправо. Расчеты выполненные комплексом HSC-5.1 показывают, что при 1273 К оксиды по ∆G0Т, ккал/мольCl2 взаимодействия с HCl располагается в ряд : Cu2O (-17.13), PbO (-17.04), CdO(-13.85), ZnO(+0.57), FeO(+1.89), CuO(+4.5), NiO(+8.29), SiO2(28.96), Al2O3(+51.3).
Для реакций (4) ∆G0Т записывается в виде:
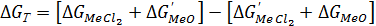 (65)
(65)
Или
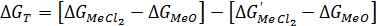 (66)
(66)
Учитывая, что в реакции обмена компоненты реагируют в эквивалентных количествах, можно записать:
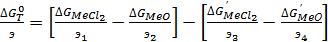 (67)
(67)
При постоянной температуре выражения, заключенные в скобках , являются величинами постоянными, для каждого элемента, по этому они могут рассматриваться как термодинамический критерий обжига. Обозначим их как КМе и К’Me тогда:
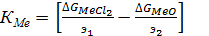 (68)
(68)
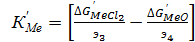 (69)
(69)
Или
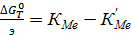 (70)
(70)
Условием протекания реакции 4 являются:
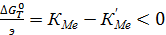 (71)
(71)
или
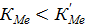 (72)
(72)
На рисунке 38 приведено влияние температуры на 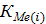 полученное Шевко В.М. и Айткуловым Д.К. По этим зависимостям можно судить о реакционной способности хлоридов. В частности с увеличением значения
полученное Шевко В.М. и Айткуловым Д.К. По этим зависимостям можно судить о реакционной способности хлоридов. В частности с увеличением значения 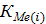 реакционная способность хлоридов возрастает. Так при 1500 К способность хлоридов возрастает следующим образом: Ge2O, SiO2, Al2O3, Fe2O3, MnO, Cr2O3, CoO, NiO, MgO, H2O,FeO, Sb2O3, ZnO, Bi2O3, SnO, Cu2O, CaO, PbO, CdO, Li2O, BaO, Na2O, K2O.
реакционная способность хлоридов возрастает. Так при 1500 К способность хлоридов возрастает следующим образом: Ge2O, SiO2, Al2O3, Fe2O3, MnO, Cr2O3, CoO, NiO, MgO, H2O,FeO, Sb2O3, ZnO, Bi2O3, SnO, Cu2O, CaO, PbO, CdO, Li2O, BaO, Na2O, K2O.
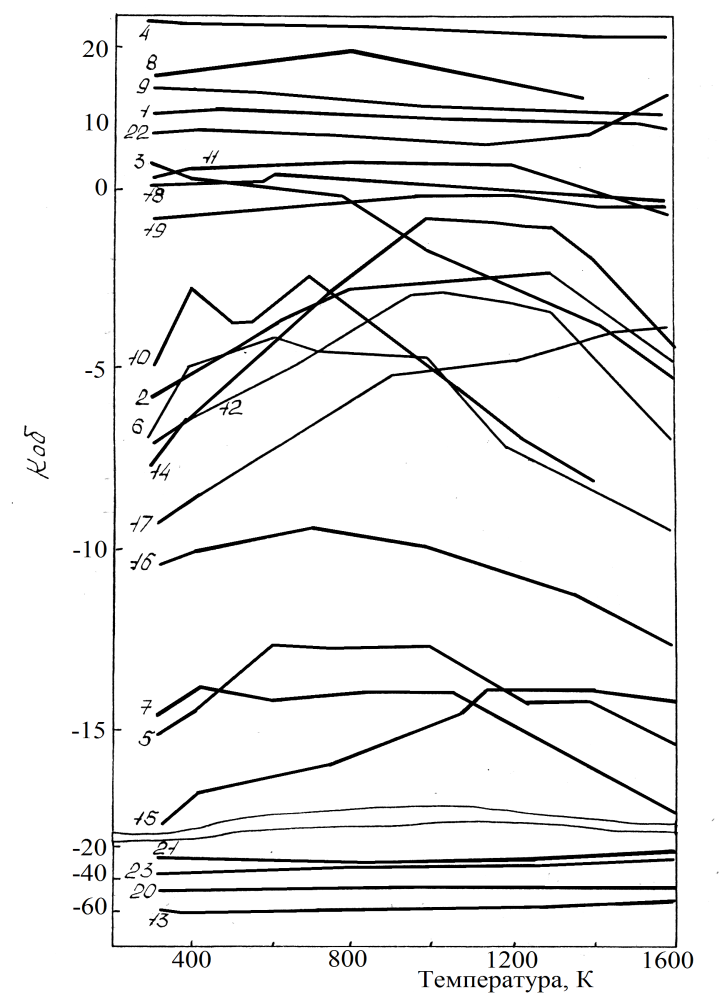
1-Al, 2-Ni, 3-H, 4-Ge, 5-Pb, 6-Zn, 7-Cd, 8-Be, 9-Si, 10-Bi, 11-Cr, 12-Fe(II), 13-K, 14-Co, 15-Ca, 16-Cu, 17-Mg, 18-Fe(III), 19-Mn, 20-Na, 21-Li, 22-Ti, 23-Ba
Рисунок 38- Влияние температуры на термодинамический критерий обмена (Коб) в оксидно хлоридных системах
На рисунке 39 приведено влияние температуры на  в сульфидно- хлоридных системах.
в сульфидно- хлоридных системах.
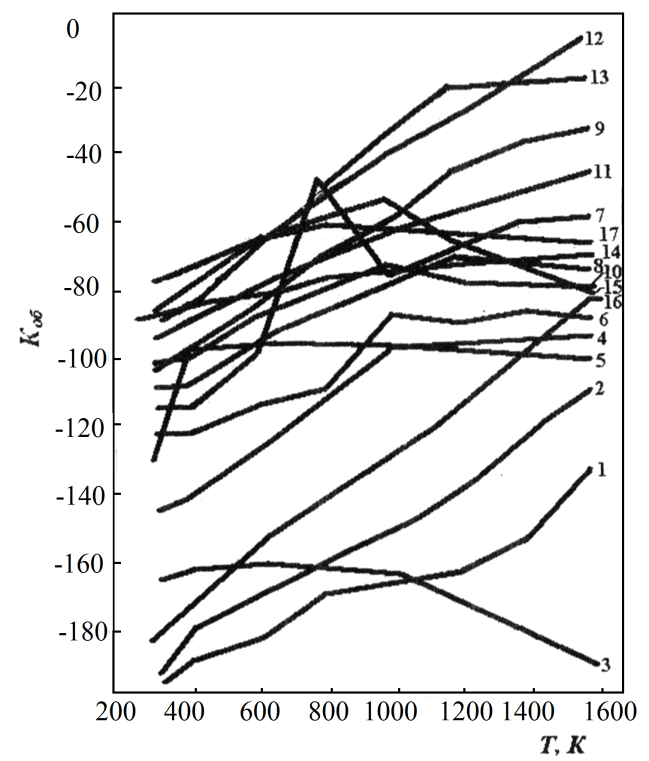
1 - К; 2 - Na; 3 - Li; 4 - Са; 5 - Н; 6 - Mg; 7 - Мn; 8 - Рb; 9 - Cd; 10 - Sn; 11-Cu( 1); 12-Ag; 13-Ni; 14-Si; 15-Zn; 16-Ba; 17-Bi.
Рисунок 39. Влияние температуры на термодинамический критерий обмена (Коб) в сульфидно-хлоридных системах
Из рисунка 39 следует, что реакционная способность сульфидов расположенной в нижней части будет максимальной, а в верхней- минимальной
Дата добавления: 2017-06-13; просмотров: 2163;











