Белки пищевого сырья
БЕЛКОВЫЕ ВЕЩЕСТВА
Белки или протеины - высокомолекулярные азотсодержащие органические соединения, молекулы которых построены из остатков аминокислот. Названием белки (или белковые вещества) в отечественной литературе принято обозначать класс соединений, которые по аналогии с белком куриного яйца при кипячении (денатурации) приобретают белый цвет. Термин "протеины", введенный Барцелиусом в 1838 г., происходит от греческого слова proteios, означающего "первостепенный". Оно достаточно точно отражает главенствующее биологическое значение важнейшего класса соединений, которое заключается в обеспечении сложной иерархии молекулярной структуры и специфических функций живых организмов.
В природе существует примерно от 1010 до 1012 различных белков, составляющих основу 1,2 · 106 видов живых организмов, начиная от вирусов и заканчивая человеком. Огромное разнообразие белков обусловлено способностью 20 протеиногенных α-аминокислот взаимодействовать друг с другом с образованием полимерных молекул с молекулярной массой от 5 тыс до 1 млн (и более) дальтон1. К примеру, включение в состав белка остатков только 15 аминокислот приводит к получению приблизительно 1,3 · 1012 изомеров. Поэтому нетрудно представить, какое многообразие белков со всеми особенностями структурной организации возможно в природе при условии включения в полимерную цепь около сотни и более протеиногенных аминокислот.
Каждый вид живых организмов характеризуется индивидуальным набором белков, определяемым наследственной информацией, закодированной в ДНК. Информация о линейной последовательности
нуклеотидов ДНК переписывается в линейную последовательность аминокислотных остатков, которая, в свою очередь, обеспечивает самопроизвольное формирование трехмерной устойчивой структуры индивидуального белка. Расположение белковых молекул в пространстве определяет их биологические функции, главными из которых являются структурная (кератин волос, ногтей, коллаген соединительной ткани, эластин, муцины слизистых выделений), каталитическая (ферменты), транспортная (гемоглобин, миоглобин, альбумины сыворотки), защитная (антитела, фибриноген крови), сократительная (актин, миозин мышечной ткани), гормональная (инсулин поджелудочной железы, гормон роста, гастрит желудка) и резервная (овальбумин яйца, казеин молока, ферритин селезенки). Резервная, или питательная, функция заключается в использовании белков в качестве источника аминокислот, расходующихся на синтез белков и других активных соединений, регулирующих процессы обмена, например, в развивающемся плоде или проростках растений. Подобного рода белки откладываются про запас в процессах созревания семян и жизнедеятельности животных. Поэтому их еще называют запасными. Запасные белки растительного происхождения, в соответствии с классификацией Осборна, относятся к классам проламинов (глиадин пшеницы, гордеин ячменя, зеин кукурузы) и глютелинов (оризенин риса, глютенин пшеницы). Такие белки достаточно широко распространены в природе и в относительно большом количестве входят в состав пищи и кормов животных.
Белковые вещества участвуют в осуществлении множества и других важнейших процессов в организме, таких, например, как возбудимость, координация движений, дифференцировка клеток. Учитывая то, что белки составляют значительную часть сухого вещества не только живых организмов, но и продуктов питания, а также то, что они наделены рядом специфических свойств и функций, которые не являются характерными для других классов соединений, определение состава и структурно-функциональной организации полипептидов заключает в себе ответ на решение многих важнейших проблем не только в биологии и медицине, но и в производстве, хранении и потреблении пищевых изделий. Углубленное изучение данного класса соединений в курсе пищевой химии (в рамках фундаментальных и прикладных исследований) необходимо в связи с конечной целью - сохранением здорового образа жизни человека и продлением сроков его жизни. Этим следует руководствоваться специалистам, занятым в современном производстве пищевых продуктов.
В естественных науках проблема белка включает два аспекта. Первый из них заключается в исследовании природы белка и его биологических функций в качестве ингредиента протоплазмы клетки, играющего первостепенную роль в развитии живых организмов (в прижизненных
процессах). Второй включает изучение его ресурсов как обязательного компонента пищи, путей их увеличения (с приданием особого значения белку растительного происхождения), разработку способов улучшения качества белка с учетом функциональных свойств и зависимости их от реакционной способности, структурной организации, физико-химических, биохимических и других видов превращений в технологических процессах производства и хранения пищевых продуктов. Несмотря на то, что обе стороны проблемы изучения белка самостоятельны, в то же время они и взаимосвязаны, так как дополняют друг друга конкретными знаниями как при изучении физиологических процессов в организме, так и процессов приготовления пищи при разработке продуктов питания и условий их хранения. Вопросы первого аспекта проблемы белка составляют предмет изучения биохимии и молекулярной биологии, второго - пищевой химии.
БЕЛКИ В ПИТАНИИ ЧЕЛОВЕКА.
ПРОБЛЕМА БЕЛКОВОГО ДЕФИЦИТА НА ЗЕМЛЕ
Белки в питании человека занимают особое место. Они выполняют ряд специфических функций, свойственных только живой материи. Белковые вещества наделяют организм пластическими свойствами, заключающимися в построении структур субклеточных включений (рибосом, митохондрий и т. д.), и обеспечивают обмен между организмом и окружающей внешней средой. В обмене веществ участвуют как структурные белки клеток и тканей, так и ферментные и гормональные системы. Белки координируют и регулируют все то многообразие химических превращений в организме, которое обеспечивает функционирование его как единого целого.
Все элементы клеток находятся в процессе обновления, при котором распад уравновешивается ресинтезом, то есть имеет место стационарное состояние фиксации равновесия. О стационарном состоянии и целостности организма свидетельствует равновесие между скоростью синтеза и распада белков тела. Постоянный обмен и обновление осуществляется между тканевыми белками и фондом свободных аминокислот, образующихся в процессе переваривания пищи и поступающих в кровь (рис. 2.1). Белки в организме человека обновляются постоянно независимо от его возраста. В молодом растущем организме скорость синтеза белков превышает скорость распада; при тяжелых заболеваниях или голодании - наоборот. Наиболее быстрому обновлению подвергаются белки печени и слизистой оболочки кишечника (до 10 дней), наиболее медленному (до 180 дней) - белки мышц (миозин), соединительной ткани (коллаген) и
мозга (миелин). Период обновления гормонов измеряется часами или даже минутами (инсулин). Скорость обновления белков выражается временем, необходимым для обмена половины всех молекул. Эта величина носит название периода полужизни (Т1/2). Средняя величина Т,/2 для белков всего организма составляет примерно 3 недели. Общая скорость синтеза белков у человека достигает 500 г в день, что почти в 5 раз превосходит потребление их с пищей. Достижение такого результата осуществляется за счет повторного использования продуктов распада белков и предшественников аминокислот в организме.
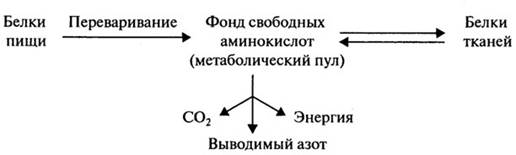
Рис. 2.1.Стационарное состояние обмена белков
Эффективность обмена белков в значительной степени зависит от количественного и качественного состава пищи. При поступлении белков (с пищей) ниже рекомендуемых норм, в организме начинают распадаться белки тканей (печени, плазмы крови и т. д.), а образующиеся аминокислоты - расходоваться на синтез ферментов, гормонов и других необходимых для поддержания жизнедеятельности организма биологически активных соединений. Повышенное количество белков в составе пищи значительного влияния на обмен веществ в организме человека не оказывает, при этом избыток продуктов азотистого обмена выводится с мочой. Состояние белкового обмена в большей степени зависит от недостатка или отсутствия незаменимых аминокислот. Клетки организма человека не могут синтезировать необходимые белки, если в составе пищи отсутствует хотя бы одна незаменимая аминокислота. Синтез белков также нарушается, если часть аминокислот в кишечнике разрушается патогенной микрофлорой, аминокислоты плохо всасываются, а протеолити-ческие ферменты желудочно-кишечного тракта мало активны. Удаление части аминокислот из организма с продуктами обмена веществ обуславливает его отрицательный азотистый баланс.
Показатель азотистого баланса используется для оценки степени обеспеченности человека белковой пищей. Он представляет собой разность между количеством поступающего с пищей азота и количеством азота, выводимого в виде конечных продуктов обмена, выраженными в одних
и тех же единицах (г/сут). При положительном балансе количество выводимого из организма азота меньше количества азота, поступающего с пищей, а при отрицательном - количество выделяемого азота превышает количество азота, поступающего в течение суток. Положительный баланс азота характерен для молодого организма и беременных женщин, отрицательный - для людей, пища которых бедна белком, для больных с нарушениями процессов переваривания пищи и людей пожилого возраста.
Состояние, при котором количество азота, поступающего с пищей, равно количеству азота, выводимого из организма, характерно для азотистого равновесия. Им обладает здоровый взрослый человек, потребляющий полноценные белки в необходимом количестве. Азотистый баланс у такого организма равен нулю.
На состояние азотистого обмена любого организма существенное влияние оказывают жиры и калорийность пищи, витамины (В,, В2, В6, РР и др.), минеральные вещества и гормоны. Например, гормоны щитовидной железы и низкокалорийная диета стимулируют распад белков, а гормоны роста и половых желез, наоборот, способствуют их синтезу. Таким образом, организм человека требует обеспечения его белковой пищей, в противном случае могут развиваться патологические процессы и наступить гибель организма. Следовательно, здесь уместно рассмотреть нормы потребления человеком белка.
Средняя суточная физиологическая потребность человека в белке в течение более чем ста лет постоянно исследуется и периодически отражается в решениях ВОЗ, ФАО и национальных организаций различных стран. Эти величины носят ориентировочный характер, так как они находятся в стадии постоянного уточнения в зависимости от возраста человека, пола, характера профессиональной деятельности, физиологического состояния, климата, индивидуальных и национальных особенностей и степени загрязнения окружающей среды. В соответствии с рекомендациями ВОЗ и ФАО величина оптимальной потребности в белке составляет 60-100 г в сутки или 12-15% от общей калорийности пищи. В общем количестве энергии на долю белка животного и растительного происхождения приходится по 6-8%. В пересчете на 1 кг массы тела потребность белка в сутки у взрослого человека в среднем равняется около 1 г, тогда как для детей, в зависимости от возраста, она колеблется от 1,05 до 4,00 г.
Приведенные здесь данные отражают общие требования к оптимальному уровню белка для обеспечения здоровья человека. К примеру, еще в 1904 г. Читтенден (Chittenden) установил, что уровень порядка 44-53 г белка в день способствует нормальному физиологическому состоянию взрослого человека (весом 70 кг). Известны случаи, когда люди хорошо
себя чувствовали при употреблении и повышенного количества белка в день, например, мяса до 337 г в сутки (Shah, 1953). Это все крайние случаи, в питании следует придерживаться рекомендуемых норм.
Рекомендуемые нормы потребления основных пищевых веществ для основных групп населения, выработанные российской научной школой питания, включают 73-120 г белка в сутки для мужчин и 60-90 г для женщин, в том числе белка животного происхождения 43-65 и 43-49 г, соответственно. Нижняя граница относится к тем, чья деятельность не связана с физическим трудом, верхняя - к людям, испытывающим тяжелые физические нагрузки. В среднем, для взрослого мужчины в возрасте 30 лет необходимый уровень потребления белка в пересчете на азот равен 9,0-9,2 г в сутки на 1 кг массы тела. Потребность в белке для лиц, перенесших тяжелые инфекции, хирургические вмешательства, имеющих заболевания органов пищеварения, дыхания, увеличивается в среднем до 110-120 г в день, а в высокобелковой диете, например, у диабетиков его количество может достигать 135-140 г. Белок ограничивается до 20-40 г в сутки при заболеваниях, связанных с почечной недостаточностью, подагре и некоторых других.
Сегодня в мире существует дефицит пищевого белка и недостаток его в ближайшие десятилетия, вероятно, сохранится. На каждого жителя Земли приходится около 60 г белка в сутки, при норме 70 г. По данным Института питания РАМН, начиная с 1992 г. в России потребление животных белковых продуктов снизилось на 25-35% и соответственно увеличилось потребление углеводсодержащей пищи (картофеля, хлебопродуктов, макаронных изделий). Среднедушевое потребление белка уменьшилось на 17-22%: с 47,5 до 38,8 г/сут белка животного происхождения (49% против 55% рекомендуемых); в семьях с низким доходом потребление общего белка в сутки не превышает 29-40 г.
Снижение употребления белка с пищей соответствует современным мировым тенденциям снижения степени обеспеченности населения Земли белком. Общий дефицит белка на планете оценивается в 10-25 млн т в год. Из 6 млрд человек, живущих на Земле, приблизительно половина страдает от недостатка белка. Нехватка пищевого белка является не только экономической, но и социальной проблемой современного мира. Не во всех странах продукты животного происхождения доступны широким слоям населения. В районах тропической Африки, Латинской Америки и Азии, население которых занято тяжелым сельскохозяйственным трудом, проблема обеспеченности белком яиц, мяса и молока особенно острая. Пока животные белки будут оставаться ценным источником питания, экономически развитым и богатым странам предстоит найти решение важной проблемы: с одной стороны, это разработка рациональных способов хранения и сбыта избытка продуктов животного
происхождения, а с другой - поиск путей получения новых ресурсов пищевого белка. В противном случае большая часть населения земного шара будет употреблять в пищу только белки растительного происхождения, отличающиеся неполноценным аминокислотным составом.
Традиционным путем увеличения ресурсов пищевого белка является повышение производительности растениеводства и животноводства на основе технологий возделывания зернобобовых, масличных и злаковых культур, употребляемых как непосредственно в пищу, так и на корм скоту. Наибольшие количества белка, и особенно лизина, обеспечивают посевы зернобобовых культур: сои, нута, чечевицы, гороха, люпина. Однако, бобовые культуры, используемые непосредственно в пищу, не являются традиционными для многих народов, к тому же трудно достичь высоких урожаев и расширения площадей посева любой культуры в силу особенностей почвенно-климатических условий выращивания и применения агротехнических мероприятий.
Растительный рацион, содержащий полноценный белок в необходимом количестве, может быть создан на основе использования пищевых продуктов, полученных из разных источников. Например, кукуруза бедна триптофаном и лизином, а бобовые - метионином, поэтому смесь, состоящая из кукурузы и соевых белковых продуктов или овощей, обеспечивает поступление в организм "качественного" белка. Возможность же использования однокомпонентного состава диеты в пище человека повышается за счет практического применения достижений генетики растений. В нашей стране и за рубежом выведены сорта вы-соколизиновой кукурузы "Опейк-2", ячменя "Хайпроли", сорго, пшеницы с повышенным количеством белка. Путем скрещивания, например, ячменя "Хай-проли" с высокобелковыми мутантами, получены сорта с содержанием лизина 4,5-4,8% и белка 13,5-15,5%. Создан гибрид ржи и пшеницы (тритикале) с 3,7% лизина и средним содержанием белка 13,4%.
В последние годы все большее внимание уделяется получению новых видов белковой пищи, производство которых основано на использовании полноценных по аминокислотному составу растительных белков. Научные и практические основы производства пищевых изделий с применением белкового сырья растительного происхождения для замены продуктов из натурального мяса, рыбы и птицы в нашей стране заложены А. Несмеяновым с сотрудниками еще в 1971 г. Однако, учитывая сложность и высокую стоимость отдельных стадий производства, данное направление пищевой промышленности только зарождается.
Увеличение количества пищевого белка за счет животноводства является менее перспективным путем, по сравнению с растениеводством. На получение 1 кг животного белка, содержащегося в молоке, мясе и яйцах, требуется израсходовать 5-8 кг кормового белка. При этом коэффициенты трансформации растительных белков в белки высокопродуктивных животных и птиц очень низкие (25-39%). В процессе трофической (пищевой) цепи теряется 60-75% белка в непереваренных остатках корма, неутилизированных в организме аминокислотах, выделяемых с мочой в виде продуктов распада, в процессах обмена (движении, обновлении белков тканей и т. д.) и через кожно-волосяные покровы. Особенно большие потери белков происходят за счет затрат на их биосинтез, так как животные белки значительно отличаются по аминокислотному составу от белков растений. Отсутствие у животных способности синтезировать ряд аминокислот приводит к тому, что свои потребности в последних они удовлетворяют за счет повышенного количества растительных белков. Организм животного может синтезировать ряд недостающих аминокислот, но только в ущерб деятельности гормональной и ферментативной систем. Отсюда актуальным является сбалансированное кормление животных (отходы мясомолочной, рыбной промышленности, соевый шрот и т.д.) в целях повышения коэффициента трансформации белков в животноводческую продукцию.
В ближайшие годы растениеводство и животноводство, вероятно, будут основными источниками пищевого белка, однако важное место в решении белковой проблемы отводится и рыболовству. В то же время запасы морепродуктов ограничены, поэтому поиск новых эффективных путей покрытия белкового дефицита с учетом природных ресурсов каждой страны остается актуальным. Так, в недавнем прошлом Россия была единственной страной, производящей микробиологический белок для кормления животных - БВК. Из объема свыше 1 млн т/год 60% продукции выпускалось на основе парафинов нефти, а 40% - на основе гидролиза-тов древесины. Организация производства белка осуществлялась и с использованием спирта и природного газа. Такие технологические процессы экономически выгодны при отсутствии соевого белка для кормления животных. По содержанию незаменимых аминокислот и витаминов дрожжевая масса не уступает, а иногда даже и превосходит соевые белки. Добавка БВК в корма экономит фуражное зерно (5 т на 1 т БВК) и увеличивает привесы животных.
В решении проблемы дефицита белка за последние два десятилетия определилось новое биотехнологическое направление - получение пищевых объектов с повышенным содержанием и улучшенным качеством белка методами генетической инженерии. Сущность генетической инженерии заключается в переносе генов любого организма в клетку реципиента для получения растений, животных или микроорганизмов с рекомбинированными генами, а следовательно, и с новыми полезными свойствами. Растения, животные и микроорганизмы, полученные генетической инженерией, называются генетически измененными, а продукты их переработки - трансгенными пищевыми продуктами.
Генетическая инженерия, или рекомбинация in vitro, включает выделение чужеродного гена ДНК, получение гибридных (рекомбинированных) молекул ДНК и введение их в живые клетки модифицируемого, например, растения для получения новых признаков организма.
ДНК растения предварительно подвергается гидролизу ферментом ре-стриктазой в специфических участках двойной спирали, при этом на обоих концах расщепленной молекулы становятся свободными четыре нук-леотида, в которых азотистые основания представлены, например, ти-мином и аденином (ТТАА и ААТТ) (рис. 2.2). Ген, который необходимо встроить в ДНК, "выщипывают" из ДНК организма-донора с помощью того же фермента рестрикции так, чтобы его концы были комплементарными нуклеотидными последовательностями на концах ДНК модифицируемого организма (ААТТ и ТТАА). Обе ДНК "сшивают" вместе ферментом лигазой. Полученную рекомбинантную ДНК вводят в клетку растения, признаки которого хотят изменить. Клетка, размножаясь, образует клон, содержащий чужеродный ген, индуцирующий синтез белка с новой аминокислотной последовательностью.

Рис. 2.2. Введение гена в ДНК модифицируемого растения
Наиболее интенсивно проводятся работы с такими сельскохозяйственными культурами как соя, пшеница, кукуруза, томаты, сахарная свекла, картофель, хлопчатник, рапс. Практические разработки уже сейчас внедрены во многих странах мира, увеличиваются площади под трансгенной соей, рисом, картофелем и ягодными культурами (малина, клубника). С генетически измененной соей только в США выпускается около 3000 пищевых продуктов: супов, рыбных консервов, детских каш, соусов и т. д.
Продукты, полученные с использованием генов микроорганизмов и растений, по сравнению с традиционными продуктами, содержат меньше пестицидов, консервантов, остаточного количества тяжелых металлов, они не требуют обработки химическими препаратами от вредителей. Трансгенная соя и кукуруза устойчивее к сорнякам и насекомым, трансгенные томаты невосприимчивы к вирусным заболеваниям, а ботва картофеля несъедобна для колорадского жука. Соя, содержащая ген пшеницы, к примеру, имеет биологическую ценность 1,0 против 0,92 у традиционной, а картофель, полученный с пересаженным геном фасоли, содержит повышенное количество белка (на 6%).
Одним из способов интенсификации производства продуктов питания с повышенным содержанием качественного белка является внедрение урожайных сортов растений, не подверженных влиянию пестицидов, гербицидов, инсектицидов, но обладающих рядом других полезных свойств (морозоустойчивость, засухоустойчивость, отсутствие способности к полеганию, определенные размеры семян и повышенная биологическая ценность).
С помощью генетически измененных бактерий получают ферменты, которые применяются при производстве глкжозного сиропа из крахмала, при производстве кондитерских, хлебобулочных изделий (амилазы), соков и вин (пектиназы). При этом улучшаются физико-химические и органолептические показатели качества пищевых продуктов.
Потребление генетически модифицированных продуктов находится под контролем специальных органов, так как введение в организм растений генов, ответственных за синтез белков, например, альбуминов молока, яиц и т.д., заключает в себе опасность употребления в пищу продуктов питания, непереносимых определенной группой людей (пищевая аллергия). Это может быть связано с появлением антиалиментарных и токсичных веществ, определяемых свойствами переносимых генов. При условии пересадки генов из микроорганизмов может синтезироваться белок с низкой усвояемостью.
Подходы к оценке безопасности и качества генетически модифицированных объектов в различных странах разные и по содержанию и объему, но во всех них разрабатываются специальные методы и критерии. Так, в России принят закон "О государственном регулировании в области генной инженерной деятельности" и создана специальная Комиссия во главе с главным санитарным врачом РФ, задача которой состоит в разработке подзаконных актов и методик для контроля общей безопасности трансгенных продуктов. С учетом выполненных комплексных мер, в РФ разрешена для использования в питании населения соя линии 40-3-2 ("Мон-санто Ко", США) и белковый концентрат из нее. Длительное включение белкового концентрата из генетически модифицированной сои в рацион крыс не сопровождалось изменениями состояния мембран клеток печени и активности ферментных систем, участвующих в защитно-адап-ционных процессах.
Таким образом признано, что ликвидация в питании человека дефицита белка всеми эффективными методами, включая генетическую инженерию, является одной из насущных проблем нашего столетия.
БЕЛКОВО-КАЛОРИЙНАЯ
НЕДОСТАТОЧНОСТЬ И ЕЕ ПОСЛЕДСТВИЯ.
ПИЩЕВЫЕ АЛЛЕРГИИ
Белковая недостаточность является важнейшей проблемой питания. Бедно живущие семьи на фоне недостаточно калорийной пищи потребляют мало белка, в результате чего возникает синдром дистрофии, который называется квашиоркором. Богатая белком пища дорого стоит, поэтому не все слои населения могут ею постоянно питаться. Кваши-оркор у человека развивается при частичном (или полном) голодании и при потреблении неполноценных белков. Заболевание сопровождается нарушением функции кишечника, так как с надлежащей скоростью не синтезируются ферменты поджелудочной железы и не обновляются клетки его слизистой оболочки. Возникает порочный круг ква-шиоркора, характеризующийся прекращением процесса усвоения белка пищи. В организме развивается отрицательный азотистый баланс, нарушается водно-солевой обмен, появляется атония мышц и остановка роста. Пищевая дистрофия особенно опасна для младенцев. Ква-шиоркор может сопровождаться их гибелью от диареи, острых инфекций, заболеваний печени и отставанием в физическом и умственном развитии. Резкое снижение синтеза белка в печени на фоне недостаточного поступления его в организм уменьшает количество сывороточного альбумина, липопротеидов низкой плотности (ЛНП) и гемоглобина в крови (рис. 2.3).
Наряду с общими нарушениями обмена аминокислот в организме существуют специфические изменения некоторых из них. Так,
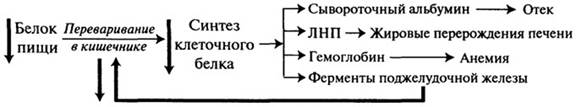
Рис. 2.3. Порочный круг при квашиоркоре
нарушения обмена гистидина выражаются в снижении активности фермента гистидинаммиакилазы и повышении активности гистидиндекарбокси-лазы. Это вызывает, в свою очередь, накопление избытка гистидина в тканях. При недостатке триптофана снижается синтез никотиновой кислоты и накапливается ксантуреновая кислота, которая угнетает р-клетки островков Лангерганса поджелудочной железы, провоцируя тем самым возникновение диабета.
Тяжелые последствия недостаточного поступления белка в организм человека невозможно лечить терапевтическими методами, поэтому предоставление всем нуждающимся материальной помощи для употребления в пищу белковых добавок может решить проблему охраны и сохранения здоровья людей как в детском, так и в зрелом возрасте. Использование в рационе полноценного животного белка или сбалансированных растительных белковых смесей необходимо для исключения необратимых отклонений в здоровье человека.
Отрицательную роль для человека играют пищевые аллергии, связанные с непереносимостью организмом отдельных видов белковой пищи (молоко, яйца, орехи, белки некоторых злаков). Термин "аллергия" происходит от двух греческих слов: "аллос" - другой и "эргон" - действие. При нормальном пищеварении белки расщепляются в желудочно-кишечном тракте до аминокислот, которые не являются антигенами (аллергенами) и не вызывают ответной иммунной (защитной) реакции. Если в кровяное русло без предварительного расщепления через эпителий кишечника проникает незначительное количество белков пищи, то в организме поддерживается как бы тренинг иммунной системы для защиты от действия чужеродных компонентов. При значительном поступлении в кровяное русло аллергенов возникает острая реакция, проявляющаяся в зуде, кожных высыпаниях или желудочно-кишечных расстройствах. Природа таких реакций до конца не выяснена. Предотвратить пищевую аллергию у младенцев возможно грудным вскармливанием или нагреванием некоторых белков до 120°С, однако наиболее эффективным способом борьбы является исключение аллергена из диеты.
АМИНОКИСЛОТЫ И ИХ НЕКОТОРЫЕ
ФУНКЦИИ В ОРГАНИЗМЕ
Общее число встречающихся в природе аминокислот достигает около 300. Среди них различают: а) аминокислоты, входящие в состав белков; б) аминокислоты, образующиеся из других аминокислот, но только после включения последних в процесс синтеза белка (их обнаруживают в гидролизатах белков); в) свободные аминокислоты. С точки зрения питания выделяют эссенциальные (незаменимые) аминокислоты. Эти аминокислоты не могут синтезироваться в организме человека и должны поступать с пищей.
Аминокислоты - полифункциональные соединения, содержащие по меньшей мере две разные химические группировки, способные реагировать друг с другом с образованием ковалентной пептидной (амидной) связи:
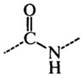
В аминокислотах амино- (-NH2) и карбоксильная (-СООН) группы присоединены к одному и тому же атому углерода, который называют а-углеродом. Природа боковых цепей 20 протеиногенных аминокислот приведена на рис. 2.4.
Для объяснения и понимания свойств аминокислот следует помнить следующее.
1. Аминокислоты, существуя в твердом или растворенном состоянии, всегда находятся в форме биполярных ионов (цвиттерионов), положение равновесия которых зависит от рН среды:
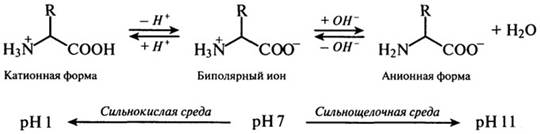
Нахождение аминокислот в виде ионов обуславливает растворимость в воде и нерастворимость в неполярных жидкостях. Большинство аминокислот растворимы в воде, но у аминокислот с гидрофобными группами (изолейцин, лейцин, тирозин) растворимость относительно невысока. В организме ионное состояние аминокислот определяет их всасываемость в желудочно-кишечном тракте после гидролитического расщепления белков и транспорт к различным органам и тканям. Способность к ионизации в кислой или щелочной среде лежит в основе разделения аминокислот ионообменной хроматографией и электрофорезом.
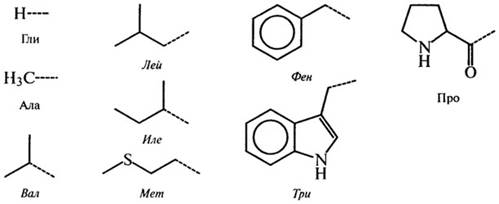
А. Гидрофобные аминокислоты (с неполярными радикалами):
Б. Полярные аминокислоты
Б1. С гидрофильными радикалами (неионогенные):
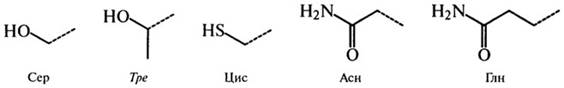
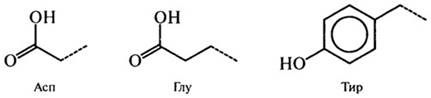
Б2. Кислые (ионогенные):
Б3. Основные (ионогенные):
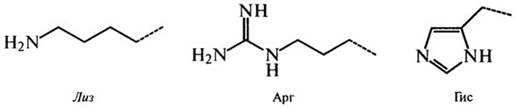
Рис. 2.4.Боковые цепи аминокислот, входящих или способных включаться в состав белков (курсивом выделены названия незаменимых аминокислот)
2. Большинство природных а-аминокислот относятся к L-стереохи-мическому ряду, однако в некоторых пептидах (антибиотики грамицидин, актиномицин) встречаются аминокислоты D-ряда. Последние, как правило, не усваиваются организмом человека. Аминокислоты D- и L-рядов значительно отличаются по вкусу. Так, D-глутаминовая кислота не имеет вкуса, а L-глутаминовая кислота обладает вкусом мяса. Получая последнюю из клейковины пшеницы, ее используют в качестве вкусовой добавки к пищевым концентратам. Сладкий вкус имеют и другие аминокислоты L-ряда: валин, треонин, пролин, серии и т. д. Они все в большей степени привлекают к себе внимание как заменители сахара в питании диабетиков.
3. Аминокислоты отличаются друг от друга структурой боковых цепей, от которой зависят химические, физические свойства и физиологические функции белков в организме. Аминокислоты с гидрофобными боковыми группами большей частью локализованы внутри белковых макромолекул, тогда как аминокислоты с полярными боковыми группами располагаются на их поверхности. В составе полярных а-аминокислот имеются функциональные группы, способные к ионизации (ионогенные) и не способные переходить в ионное состояние (неионогенные). При этом кислые и основные ионогенные группы радикалов, как правило, располагаясь на поверхности молекул белков, принимают участие в ионных (электростатических) взаимодействиях. В роли полярных неионогенных групп в молекулах белков выступают гидроксильные группы серина, треонина и амидные группы глутамина (Глн) и аспарагина (Асн). Эти группы могут располагаться как на поверхности, так и внутри белковой молекулы, и принимать участие в образовании водородных связей с другими полярными группировками.
Почти все а-аминокислоты, поступающие из пищеварительного тракта человека в кровяное русло организма, претерпевают ряд общих превращений, назначение которых заключается в обеспечении пластическим материалом процесса синтеза белков и пептидов и осуществлении дыхания с образованием АТФ (рис. 2.5). В основе таких превращений

Рис.2.5. Основные функции аминокислот в организме
лежат реакции дезаминирования, трансаминирования и декарбоксили-рования. Эти реакции подробно рассматриваются в курсе биохимии, здесь же остановимся на специфических путях обмена и модификации отдельных а-аминокислот.
В тканях организма легко осуществляется ферментативная окислительно-восстановительная реакция, обусловленная наличием в цистеи-не реакционноспособной SH-группы:
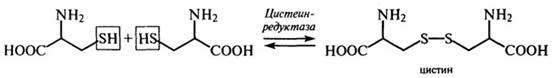
Свойство данной аминокислоты окисляться придает ей защитные и радиопротекторные свойства. В присутствии цистеина снижается интенсивность окислительных процессов в липидах и белках, повышается устойчивость организма к ионизирующим излучениям и стабилизируется качество принимаемых лекарственных препаратов. При участии двух остатков цистеина в полипептидных цепях образуются дисульфидные связи, которые обуславливают биологическую активность или функциональные свойства белков в составе пищи. Особо важную роль дисульфидные связи играют в белках пшеницы, так как они придают клейковине упругие свойства (см. Белки злаков).
Основная физиологическая роль другой серосодержащей аминокислоты - метионина - связана с наличием лабильной метальной группы. Отдавая группу - СН3 через образование S-аденозилметионина, метио-нин принимает участие в синтезе глицерофосфолипидов:
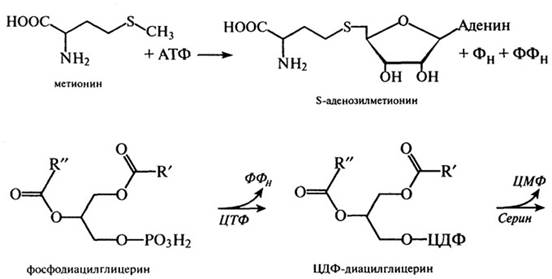
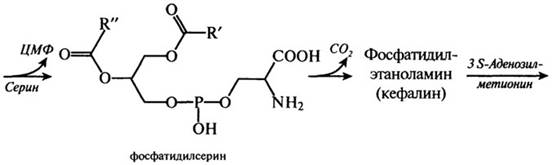
В приведенных реакциях синтеза глицерофосфолипидов видна физиологическая роль и аминокислоты серии, которая, как и треонин, в этерифицированном виде при участии фосфорной кислоты в большом количестве входит в состав сложных белков - фосфопротеидов (казеина молока и вителлина яйца):
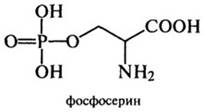
Серии в свою очередь синтезируется из глицина под действием фермента, содержащего тетрагидрофолевую кислоту (ТГФК). Эта реакция изучена с помощью метода меченых атомов:
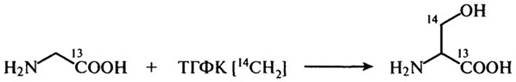
Глицин является предшественником пуринового кольца тема крови и образует так называемые парные соединения. С желчными кислотами, например холевой кислотой, он образует гликохолевую кислоту, с бензойной кислотой - гиппуровую кислоту:
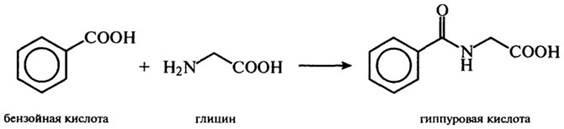
Гликохолевая кислота принимает участие в процессе усвоения липи-дов, а в форме гиппуровой кислоты из организма выводится токсичная бензойная кислота.
Три аминокислоты - аргинин, глицин и метионин - участвуют в синтезе креатина - соединения, с помощью которого в мышечной ткани происходит непрерывный ресинтез макроэрга АТФ:
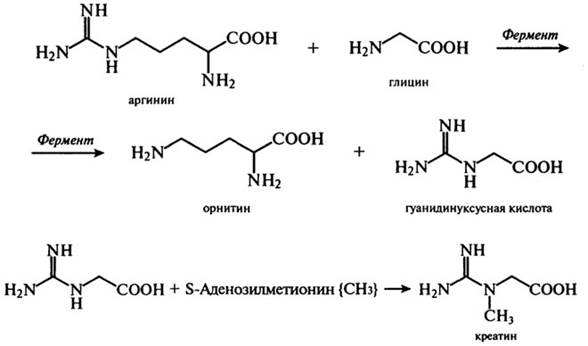
При участии креатина в организме человека и животных образуется креатинфосфат, который по мере необходимости отдает свою фосфатную группу молекулам АДФ, превращаясь в креатинин:
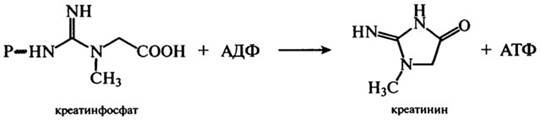
Креатин и циклический креатинин входят в состав мясного экстракта, их соотношение зависит от рН среды и температуры. Так, при нагревании мяса в кислой среде
Дата добавления: 2016-12-16; просмотров: 3850;











