Реакции окисления карбонильных соединений
Альдегиды легко окисляются органическими окислителями (KMnO4 в нейтральной и кислой среде, K2Cr2O7 в кислой среде) до карбоновых кислот

В промышленном масштабе окисление осуществляется кислородом воздуха
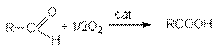
при катализе солями Mn4+, Co3+, Ni3+ и др.
В качестве неорганических окислителей могут выступать также аммиачный раствор оксида серебра (реагент Толленса) и реактив Фелинга, который содержит комплексно связанный с винной кислотой Cu2+.
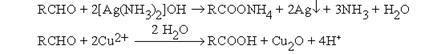
Выделяющиеся в первой реакции металлическое серебро и во второй – красный оксид меди (I) являются тестами на альдегидную группу.
Кетоны к действию окислителей весьма устойчивы и окисляются лишь сильными окислителями при нагревании. Реакция имеет деструктивный характер: при окислении происходит разрыв С-С связи по обе стороны карбонильной группы
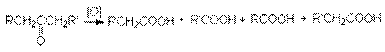
В этих реакциях используют те же окислители, что и при окислении альдегидов: неорганические окислители в препаративном органическом синтезе и кислород в промышленности.
Реакции окислительно-восстановительного диспропорционирования
В этих реакциях карбонильная группа проявляет двойственную функцию – окислителя и восстановителя.
Реакция Канницциаро
Альдегиды, которые не содержат водородных атомов при карбонильной группе реагируют в концентрированном водном растворе щелочи, давая 1 моль спирта и 1 моль карбоновой кислоты (в виде соли)
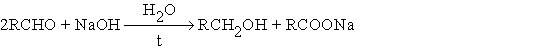
Поскольку формальдегид окисляется легче ароматических альдегидов возможна перекрестная реакция Канниццаро, в которой формальдегид окисляется в муравьиную кислоту, а ароматический альдегид восстанавливается до спирта
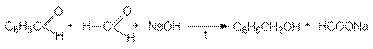
2. Реакция Тищенко.
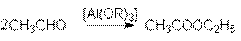
Дата добавления: 2017-04-05; просмотров: 1445;











