Химические свойства карбоновых кислот
Большинство реакций карбоновых кислот может быть отнесено к одному из четырех основных типов:
1.Реакции, сопровождающиеся разрывом О-Н-связей, например, кислотная диссоциация.
2.Реакции по карбонильному углероду, которые имеют нуклеофильный характер.
3.Реакции расщепления
4.Реакции по -углеродному атому алкильной группы.
Кислотность карбоновых кислот
По сравнению со спиртами карбоновые кислоты обладают более высокой кислотностью. При этом в растворе реализуется равновесие.
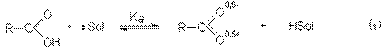
Кислотность карбоновых кислот проявляется в их взаимодействии с активными металлами и основаниями.
2RCOOH + 2Na 2RCOONa + H2
RCOOH + NaOH RCOONa + H2O
2RCOOH + Na2CO3 2RCOONa + H2O + CO2
Основность карбоновых кислот
Несмотря на малую концентрацию протонированной формы присутствие небольших количеств сильных кислот исключительным образом влияет на реакционную способность карбоновых кислот: повышение положительного заряда на карбонильном углероде делает его восприимчивым к атаке нуклеофильными реагентами и открывает возможность для протекания многих реакций нуклеофильного замещения карбоновых кислот.
Реакции нуклеофильного замещения
1.Реакции этерификации
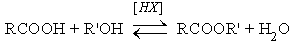
2. Реакции с N-нуклеофилами (аммиаком, аминами, гидразином и др.).
N-нуклеофилы при взаимодействии с карбоновыми кислотами как правило образуют аммониевые соли (карбоксилаты) и только при повышенных температурах происходит присоединение N-нуклеофила к карбонильному углероду.
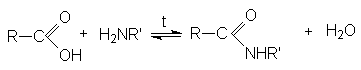
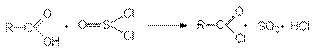
3. Взаимодействие с галогенангидридами хлорорганических кислот (PCl3, PCl5, PBr3, SOCl2 ).
Реакции расщепления
1. Синтез Кольбе (см. подробно методы получения алканов).
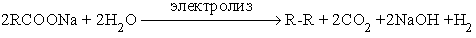
2. Пиролиз карбоновых кислот.
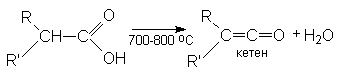
3. Реакция Хунсдиккера.
RCOOAg + Br2 RBr + CO2 + AgBr
В качестве объекта декарбоксилирования выступают серебряные или ртутные соли карбоновых кислот, а реагентами являются бром или йод.
Предполагают, что промежуточным продуктом этой реакции является гипогалогенит, который распадается на радикалы:
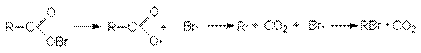
Эту реакцию можно осуществлять без выделения чистых солей ртути или серебра
2RCOOH + HgO + 2Br2 2RBr + HgBr2 + H2O + 2CO2
4. Пиролитическая кетонизация солей карбоновых кислот
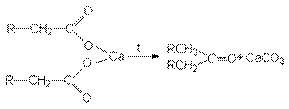
Галогенирование по Гелю-Форгальду-Зелинскому
Эта реакция является примером взаимодействия по -углеродному атому по отношению к карбоксильной группе. Реакция бромирования протекает энергично и с хорошим выходом в присутствии небольших количеств фосфора.
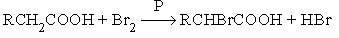
Функция фосфора состоит в образовании трехбромистого фосфора, который, реагируя с кислотой, дает ацилбромид. Последний гораздо легче подвергается енолизации по сравнению с исходной кислотой. Бром по видимому реагирует с енолом ацилбромида так же как с енолами кетонов.
2P + 3Br2 2PBr3
RCH2COOH + PBr3 RCH2COBr + POBr + HBr
Реакции восстановления карбоновых кислот
В целом карбоновые кислоты с трудом поддаются восстановлению как путем каталитического гидрирования, так и при действии натрия в спирте, но восстановление до первичных спиртов при действии литийалюминийгидрида или натрийборгидрида протекает достаточно энергично.
4RCOOH + 3LiAlH4 [(RCH2O)4Al]Li + 4H2 + 2LiAlO2
[(RCH2O)4Al]Li + 3H2O + HCl RCH2OH + Al(OH)3 + LiCl
Дата добавления: 2017-04-05; просмотров: 3182;











