Очистка воды от растворенных газов
10.1. Общие положения
Удаление из воды растворенных газов – важная часть комплексного технологического процесса обработки воды, реализуемого на ТЭС и АЭС. Необходимость этого процесса вызвана стремлением уменьшить интенсивность коррозии внутренних поверхностей теплосилового оборудования под действием растворенных в теплоносителе агрессивных газов. Кроме того, наличие в воде растворенной углекислоты отрицательно сказывается на эффективности работы анионитных фильтров, установленных в схеме очистки добавочной воды.
Один из основных потоков, подвергаемых дегазации – питательная вода котлов. Однако растворенные газы удаляют и из потоков, не являющихся непосредственно рабочим телом. Такими потоками являются химически очищенная вода, подпиточная вода тепловых сетей, конденсат пара, возвращаемый в тепловой цикл станции от внешних потребителей, охлаждающая вода конденсаторов турбин.
Кислород О2 и диоксид углерода СО2 присутствуют в воде в результате растворения при контакте воды с атмосферным воздухом. Углекислота появляется в воде также в процессе химического обессоливания после стадии Н-катиониро-вания, а при умягчении воды методами Na- и Н- Na-катионирования вода дополнительно насыщается связанным диоксидом углерода. Азот – инертный газ, его наличие в воде обусловлено контактом воды с атмосферным воздухом, появление водорода Н2 в воде – коррозией внутренних поверхностей теплосилового оборудования. Аммиак NН3 попадает в воду главным образом в результате аминирования питательной воды и, кроме того, присутствует в химически очищенной воде, если в схеме подготовки воды установлены NН4-катионитные фильтры. Такие газы, как сернистый ангидрид SO2 и сероводород H2S, могут присутствовать в теплоносителе при использовании на станции котлов среднего давления и обработке питательной воды сульфитом натрия.
Наиболее эффективный способ удаления растворенных газов из воды – десорбция. Этот способ основан на известных законах Генри–Дальтона, характеризующих зависимость между концентрацией в воде растворенного газа и его парциальным давлением.
Применение этих законов дает возможность определить концентрацию газа при том условии, что в паровом пространстве над водой находится лишь рассматриваемый газ и отсутствуют другие газы. Концентрация растворенного в воде газа выражается уравнением
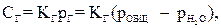
| (10.1) |
где СГ – концентрация растворенного в воде газа; КГ – коэффициент абсорбции газа водой: рОБЩ – общее давление; 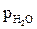 – парциальное давление водяного пара;
– парциальное давление водяного пара;
рГ – парциальное давление газа.
|
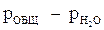 ), т.е. в случае приближения парциального давления водяных паров к значению полного давления газовой смеси. Это достигается созданием над поверхностью воды, содержащей рассматриваемый газ, смеси газов, в составе которой практически отсутствует удаляемый из воды газ. Таким образом, для удаления газа из воды необходимо создать условия, при которых парциальное давление его над поверхностью воды было бы равно нулю.
), т.е. в случае приближения парциального давления водяных паров к значению полного давления газовой смеси. Это достигается созданием над поверхностью воды, содержащей рассматриваемый газ, смеси газов, в составе которой практически отсутствует удаляемый из воды газ. Таким образом, для удаления газа из воды необходимо создать условия, при которых парциальное давление его над поверхностью воды было бы равно нулю.
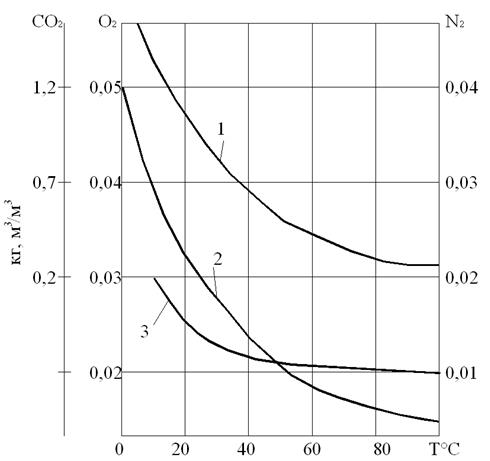
Рис.10.1. Коэффиценты абсорбции СО2 (1), N2 (2) и О2 (3) водой
Удаление газа из воды существенно зависит от кинетики десорбции, которая может быть выражена уравнением
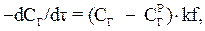
| (10.2) |
где dC/dτ – скорость десорбции; СГ – концентрация удаляемого газа; 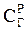 – равновесная концентрация газа; k – коэффициент пропорциональности; f – удельная поверхность раздела фаз.
– равновесная концентрация газа; k – коэффициент пропорциональности; f – удельная поверхность раздела фаз.
Наибольший эффект достигается при 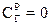 , т. е. при парциальном давлении удаляемого газа, близком к нулю. В этом случае уравнение (10.2) преобразуется к виду
, т. е. при парциальном давлении удаляемого газа, близком к нулю. В этом случае уравнение (10.2) преобразуется к виду
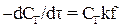 . .
| (10.3) |
При постоянных k и f для данного аппарата концентрация газа в воде зависит от времени дегазации, с увеличением времени дегазации концентрация растворенного газа в воде уменьшается. Полного освобождения воды от растворенного газа в какой-либо реальный отрезок времени достичь невозможно, поэтому время, необходимое для дегазации, находят, задаваясь определенной конечной концентрацией растворенного в воде газа.
Эффект дегазации можно повысить, увеличив удельную поверхность раздела фаз пара и воды. В этом случае при прочих равных условиях увеличивают время контакта воды с паром, не содержащим удаляемого из воды газа. На эффект дегазации существенно влияет повышение температуры воды, это обусловлено тем, что с повышением температуры уменьшается коэффициент абсорбции газа водой. На рис. 10.1 показана зависимость коэффициента абсорбции от температуры для кислорода, углекислоты и азота.
10.2. Удаление свободной углекислоты
Удаление из воды свободной углекислоты методом аэрации широко применяют на ВПУ ТЭС и АЭС. Использование термической деаэрации для удаления углекислоты в этих схемах нежелательно вследствие нагревания воды, которую пришлось бы после этого охлаждать для очистки в последующих ступенях схемы водоподготовки. Сущность метода аэрации заключается в продувании воздуха, свободного от углекислоты, через воду. Таким образом, при использовании данного метода, так же как и при термической деаэрации воды, над поверхностью обрабатываемой воды создается атмосфера, в которой парциальное давление углекислоты ничтожно мало по сравнению с парциальным давлением углекислоты в воде.
Удаление углекислоты производят в аппаратах, называемых декарбонизаторами, а сам процесс носит название декарбонизации. Декарбонизацию проводят в аппаратах как пленочного, так и барботажного типа. Принципиальная схема декарбонизатора пленочного типа представлена на рис. 10.2.
Декарбонизатор представляет собой цилиндрический стальной бак 1, внутри которого располагается насадка 2, состоящая из деревянных досок, уложенных в шахматном порядке с зазором, или из колец Рашига, представляющих собой керамические кольца. Вода подается в декарбонизатор сверху через патрубок 4. Со щита 6 она сливается через распределительные сопла 5 на поверхность насадки. Обрабатываемая вода омывает элементы насадки тонким слоем, а навстречу ей движется воздух, подаваемый в декарбонизатор вентилятором через патрубок 7. Удаляемая из воды углекислота переходит в воздух и вместе с ним выводится из декарбонизатора в атмосферу через патрубок 3. Прошедшая очистку вода стекает в поддон декарбонизатора и через гидравлический затвор по патрубку 8 поступает в бак декарбонизованной воды, который располагается под днищем декарбонизатора.
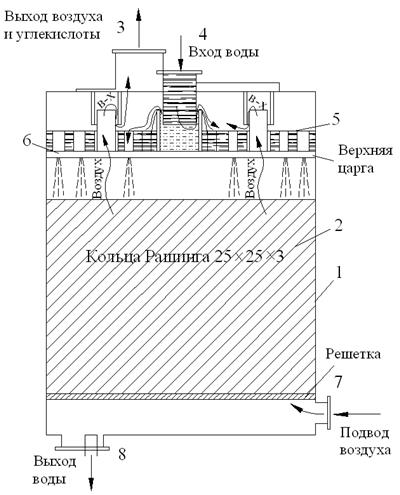
Рис.10.2. Принципиальная схема декарбонизатора
При правильно выбранной площади поверхности контакта воды с воздухом и достаточном расходе воздуха использование декарбонизатора пленочного типа позволяет снизить концентрацию растворенной углекислоты в декарбонизованной воде до 3 – 7 мг/дм3.
Конструкция барботажного декарбонизатора предусматривает продувку сжатого воздуха снизу через всю площадь сечения бака, в который сверху поступает обрабатываемая вода. Для этих аппаратов требуется более высокое давление воздуха, подаваемого компрессором, чем для декарбонизаторов пленочного типа. Кроме того, необходимо предусматривать очистку воздуха от смазочного масла компрессора.
В практике обработки воды получили широкое применение декар-бонизаторы с насадкой из колец Рашига. Расчет декарбонизатора состоит в определении геометрических размеров необходимой поверхности колец Рaшига и определении напора, создаваемого вентилятором. Площадь поперечного сечения декарбонизатора определяется по плотности орошения насадки, т. е. по расходу воды, приходящемуся на единицу площади поперечного сечения декарбонизатора. Плотность орошения для декарбонизатора с насадкой из колец Рашига принимают равной 60 м3/(м2·ч).
Таким образом, площадь поперечного сечения декарбонизатора, м2:
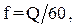
| (10.4) |
где Q – производительность декарбонизатора, м3/ч.
Диаметр декарбонизатора в метрах определяют из уравнения:
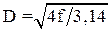 . .
| (10.5) |
Размер колец Рашига независимо от производительности декарбонизатора cocтавляет 25´25´3 мм. Поверхность единицы объема колец Рашига равна 204 м2/м3, а масса 532 кг/м3. Количество колец при беспорядочной загрузке составляет 53200 шт/м3, свободный объем на 1 м3 насадки равен 0,74 м3/м3.
Необходимую поверхность насадки в метрах определяют из уравнения:
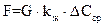 , ,
| (10.6) |
где G – количество удаляемого газа, кг/ч; ΔСср – средняя движущая сила десорбции, кг/м3 , kж – коэффициент десорбции, м/ч.
|
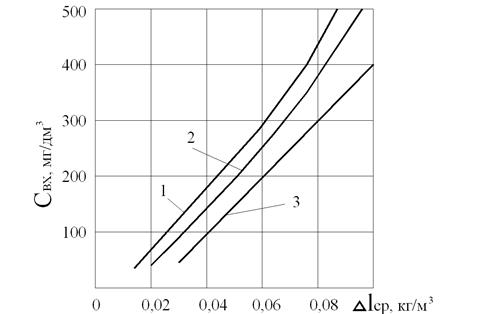
Рис. 10.3. Зависимость средней движущей силы десорбции
от концентрации углекислоты в воде до декарбонизатора
при концентрации СО2 в декарбонизированной воде 3(1), 5(2) и 10(3) мг/дм
G определяют исходя из значений концентрации углекислоты в воде, поступающей в декарбонизатор, СВХ и в декарбонизованной воде СВЫХ и нагрузки декарбонизатора Q:
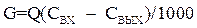 . .
| (10.7) |
Значение СВЫХ обычно принимают в пределах 3–10 мг СО2/кг Н2О. Значение СВХ, миллиграмм на кубический дециметр, можно определить по уравнению
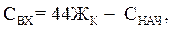
| (10.8) |
где Жк – карбонатная жесткость воды после предочистки, ммоль/дм3;
СНАЧ – концентрация свободной углекислоты в исходной воде, мг/дм3:
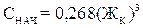 . .
| (10.9) |
Высота слоя в метрах насадки из колец Рашига определяется из уравнения:
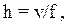
| (10.10) |
где v – объем, занимаемый кольцами Рашига при беспорядочной загрузке, м3:
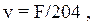
| (10.11) |
где 204 – площадь поверхности единицы объема слоя насадки из колец Рашига, м2/м3.
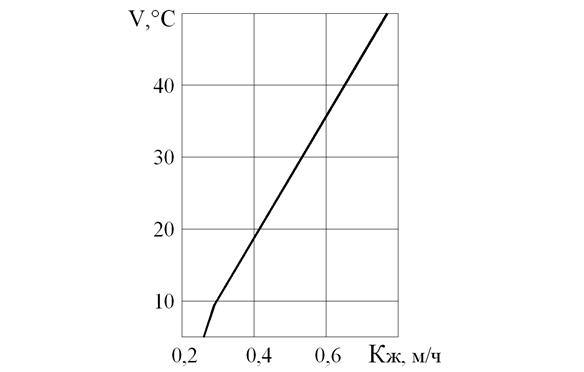
Рис. 10.4. Зависимость коэффициента десорбции
от температуры обрабатываемой воды
На основании расчета необходимо произвести выбор декарбонизатора из выпускаемых промышленностью, при этом необходимо обеспечить 25-процентный запас производительности по воде против расчетного.
10.3. Удаление кислорода физико-химическими методами
Удаление кислорода из воды производится десорбционными (физическими) и химическими методами.
Десорбционный метод удаления кислорода реализуется в термических деаэраторах, в которых происходит нагрев воды паром до температуры ее кипения при одновременном равномерном разбрызгивании жидкости и удалении из нее растворенных газов. В соответствии с законами Генри и Дальтона условиями хорошей работы деаэраторов являются нагревание воды до температуры кипения при давлении, поддерживаемом в аппарате, что обеспечивает практически равенство давления водяных паров общему давлению в газовой фазе, тонкое распыливание и равномерное распределение воды по сечению деаэратора, хорошее удаление паро-воздушной смеси из аппарата (количество выпара должно поддерживаться в пределах 3–5 % расхода греющего пара, что составляет 1–2 кг пара), достаточное время для выделения газов, определяемое правильным выбором размеров деаэраторной головки, равномерную нагрузку аппарата.
10.4. Деаэрация в деаэраторах атмосферного
и пониженного давления
Деаэраторы атмосферного давления, точнее работающие под небольшим избыточным давлением, применяются на ТЭС для деаэрации питательной воды паровых котлов, испарителей, паропреобразователей, подпиточной воды теплосетей (с охлаждением в водо-водяных теплообменниках) (рис. 10.5), а также для предварительной деаэрации загазованных составных частей питательной воды паровых котлов ВД и СВД (обессоленная вода, бойлерный конденсат, дистиллят, дренажи, конденсат из запасных баков – БЗК и др.), если их нельзя направить для предварительной деаэрации в конденсаторы турбин.
Защитные устройства – гидрозатворы – для предотвращения заброса воды из деаэраторного бака во внезапно остановившуюся турбину применяются на ТЭС.
Вакуумная деаэрация может применяться при температуре 40–80 °С и абсолютном давлении 0,0075–0,05 МПа. Вакуум создается и поддерживается водяными эжекторами типов ЭВ-1, ЭВ-75, а при большой производительности (более 400 м3/ч) еще и паровыми эжекторами, например типа ЭП-3-25/75 ХТГЗ, а также вакуум-насосами. Наиболее целесообразна последовательная установка эжекторов: сначала парового (первой ступени), а затем водяного, выполняющего одновременно роль конденсатора. Водяной эжектор работает на деаэрируемой воде, подаваемой затем в деаэратор.
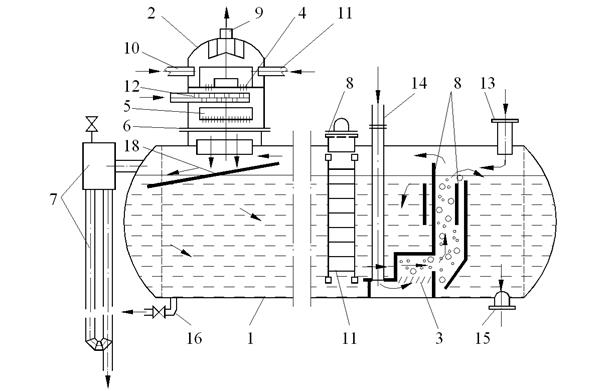
Рис. 10.5. Струйно-барботажный деаэратор атмосферного давления (ДСА-ДА):
1 – деаэраторный бак, 2 – деаэрационная колонка, 3 – барботер "домик", 4, 5 – верхняя и нижняя тарелки, 6 – фланцевый разъем, 7 – гидрозатвор-перелив, 9 – отвод выпара в охладитель, 10 – подвод химически обработанной воды, 11, 12 – подвод холодного и горячего конденсата, 13, 14 – подвод основного и барботажного пара, 15 – отвод деаэрированной воды, 16 – опорожнение, 17 – лестница, 18 – направляющий лист
При коагуляции воды без известкования вакуумный деаэратор может быть установлен на ВПУ после ввода реагентов, так как это позволяет уменьшить содержание в воде кислорода и СО2, выделившейся при коагуляции.
В схемах с параллельным или последовательным Н-Na-катионированием или голодным Н-катионированием деаэратор целесообразно устанавливать вместо декарбонизатора после смешивания кислой воды со щелочной.
В качестве вакуумных, кроме специальных конструкций (рис. 10.6), могут применяться и деаэраторы обычного типа после проверки их прочности и производительности при работе под полным вакуумом и необходимого укрепления стенок деаэраторных баков, а в отдельных случаях и колонок. Могут быть применены и смешивающие деаэраторы-подогреватели конструкции типа Уралэнергочермета (рис. 10.7.). В них вода подогревается и деаэрируется как в струях, так и в водяном объеме путем барботажа. Деаэраторы должны снабжаться автоматическими регуляторами уровня, температуры и вакуума.
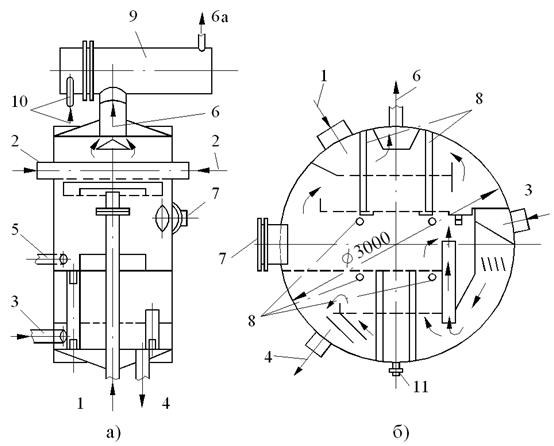
Рис.10.6. Вакуум-деаэраторы (по каталогу НИИЭинформэнергомаш):
а) ДСВ-ДВ Q = 25–300 т/ч; б) ДСВ-ДВ Q = 400 т/ч; (одна секция l = 2000 мм); 1 – вход воды; 2 – вход воды из охладителя выпара; 3 – вход пара; 4 – отвод воды ; 5 – ввод конденсата; 6 – выход выпара; 6а – к эжектору; 7 – лаз (d = 400–500 мм); 8 – подвески-стяжки; 9 – охладитель выпара; 10 – подвод и отвод воды в охладитель выпара; 11 – дренаж
Применяя последние конструкции вакуумных деаэраторов большой производительности, можно деаэрировать подпиточную воду тепловых сетей с водогрейными котлами, используя для подогрева пар, получаемый при самоиспарении подогретой прямой сетевой воды. Возможен также подогрев холодной деаэрируемой воды горячей сетевой водой в поверхностных подогревателях с коррозионно-стойкими поверхностями нагрева, а также подогрев-кипячение воды, в деаэраторных баках горячей прямой сетевой водой (взамен парового барботажа).
Основным условием для обеспечения надежной работы вакуумного деаэратора, кроме обеспечения вакуума в соответствии с температурой воды является высокая герметичность, обеспечивающая отсутствие подсосов, особенно в водяной части. Трубопровод от колонки до деаэраторного бака должен быть цельносварным. Отдельную деаэрационную колонку необходимо размещать на высоте
11–12 м (но не менее 4–5 м) над деаэраторным баком, чтобы вода в нем, арматура и насосы находились под давлением. Это дает возможность избежать подсосов воздуха. Если невозможно размещение вакуумно-деаэраторной колонки на такой высоте, необходимо более надежно обеспечить отсутствие подсосов воздуха в агрегате (водяное уплотнение сальников, задвижек, насосов и других приборов и аппаратов установки).
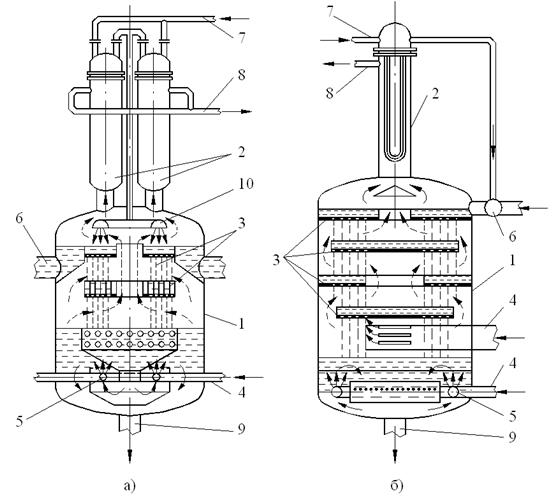
Рис. 10.7. Смешивающий вакуумный струйно-барботажный деаэратор
конструкции Уралэнергочермета:
а), б) – варианты; 1 – корпус (корпус фильтра); 2 – охладитель выпара; 3 – разбрызгивающие тарелки с отверстиями; 4 – подвод пара в барботер; 5 – барботер; 6 – подвод воды; 7 – подвод охлаждающей воды в охладители выпара; 8 – отвод выпара к эжектору;
9 – отвод деаэрированной воды; 10 – разбрызгиватель
В деаэраторные баки воду из колонок следует подводить снизу и организовывать в баках паровую или газовую (азотную) подушку, устанавливать поплавки, применять «одеяла» из герметика и т. д.
Скорости в трубопроводах, подводящих воду в колонки деаэраторов, не должны превышать 1,5 м/с, а отводящих воду – 1 м/с. Скорость в трубопроводах паровоздушной смеси должна быть не более 10 м/с. Для сокращения длины трубопровода, отводящего паровоздушную смесь, и уменьшения объема парогазовой смеси необходимо охладители выпара устанавливать над колонками, а паровые эжекторы – возможно ближе к ним на 5–7 м выше уровня в баке рабочей воды, и на охлаждение подавать наиболее холодную воду.
10.5. Химические методы удаления газов из воды
Химическое связывание кислорода в коррозионно-инертные вещества производится несколькими способами, в основе каждого из которых лежат окислительно-восстановительные процессы. Так как эти процессы характерны еще для целого ряда типичных приемов водообработки, например для очистки от биологических загрязнений, и важны при оценке коррозии конструкционных материалов основного и вспомогательного оборудования, то напомним читателям вначале их основные положения.
Окислительно-восстановительные реакции состоят из процессов окисления (отдачи электронов веществом) и восстановления (получения или смещения электронов к веществу). Вещество, отдающее свои электроны в процессе реакции, называется восстановителем, а вещество, принимающее электроны - окислителем. Некоторые вещества могут существовать в окисленной и восстановленной формах и способны переходить из одной формы в другую, получая электроны или теряя их. За исключением кислорода и водорода, которые в состоянии действовать соответственно только как окислительный и только как восстановительные агенты, остальные вещества в зависимости от условий могут быть либо окислителями, либо восстановителями, что характеризуется окислительно-восстановительным или редокс-потенциалом реакционной системы. Редокс-потенциал зависит от активности окислительной и восстановительной формы в соответствии с уравнением Нернста:
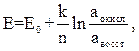
| (10.12) |
где n– число электронов, участвующих в окислительно-восстановительной реакции; k–параметр, зависящий от температуры; Еo – стандартный потенциал, определяющий равенство активностей окисленной и восстановленной форм.
Окислительно-восстановительный потенциал служит мерой окислительной и восстановительной способностей системы. Вещество А, имеющее более высокий стандартный потенциал, чем вещество Б, будет последнее окислять, а вещество Б будет восстанавливать вещество А.
Стандартные потенциалы Еo ряда веществ (элементов), используемых в процессах обработки воды (нулевой стандартный потенциал имеет, как известно, водородный электрод), следующие: фтора 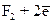 D
D 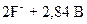 ;
;
хлора 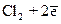 D
D 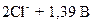 ; озона
; озона 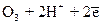 D
D 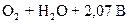 ; железа
; железа 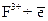 D
D 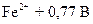 ; сульфата
; сульфата 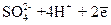 D
D 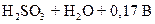 ; хрома
; хрома 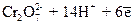 D
D 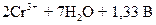 ; марганца
; марганца 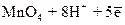 D D
D D 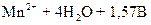 ; кислорода
; кислорода 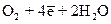 D
D 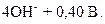
Из изложенного видно, что наиболее сильными окислителями являются ионы 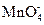 и
и 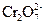 , используемые для определения перманганатной или бихроматной окисляемости, а также фтор, озон и хлор.
, используемые для определения перманганатной или бихроматной окисляемости, а также фтор, озон и хлор.
Химические методы удаления из воды растворенных газов заключаются, как отмечалось, в связывании их в новые химические соединения. Строгое нормирование кислородсодержания при использовании восстановительных водных режимов в контурах ТЭС с барабанными котлами, в теплосетях определяет необходимость использования не только физических методов дегазации, но и химических методов дообескислороживания, основанных на окислительно-восстановительных процессах с участием кислорода и специальных восстановителей.
К числу используемых восстановителей относятся такие реагенты, как сульфит натрия, гидразин и окислительно-восстановительные группы, создаваемые на высокомолекулярных, нерастворимых в воде полимерах (например, на редокс-ионитах).
Обработка воды сульфитом натрия основана на реакции окисления сульфита растворенным в воде кислородом:
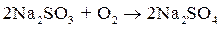 . .
| (10.13) |
Реакция (10.13) протекает достаточно быстро при температуре воды не менее 80 °С и рН ≤ 8. При сульфитировании питательной воды увеличивается ее сухой остаток в количестве 10–12 мг/дм3 на 1 мг/дм3 растворенного кислорода. Следует учитывать также, что при температуре свыше 275 °С, соответствующей давлению насыщения 6 МПа, сульфит подвергается гидролизу и процессу самоокисления-самовосстановления:
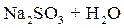 D D 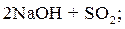
| (10.14) |
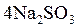 D D 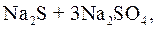
| (10.15) |
что допускает использование этого метода обескислороживания только для котлов среднего давления (3–6 MПа) и для подпиточной воды тепловой сети.
Для прямоточных котлов и барабанных котлов высоких и сверхвысоких параметров применяется обескислороживание воды гидразином в форме гидразин-гидрата 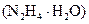 , который энергично взаимодействует с кислородом, окисляясь в конечном счете до воды и азота, т. е. не повышая солесодержания воды:
, который энергично взаимодействует с кислородом, окисляясь в конечном счете до воды и азота, т. е. не повышая солесодержания воды:
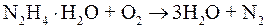 . .
| (10.16) |
В этой реакции восстановителем является группировка атомов азота 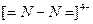 , которая отдает четыре электрона молекуле кислорода. Основными факторами, определяющими скорость этой реакции, являются температура, рН среды, избыток гидразина в соответствии с законом действия масс, а также присутствие катализаторов. При комнатной температуре скорость взаимодействия гидразина и кислорода минимальна, но быстро увеличивается с повышением температуры. Так, при t = 105 °С, рН = 9–9,5 и избытке гидразина около 0,02 мг/дм3 время практически полного связывания кислорода составляет 2–3 с. При рН среды менее 7 гидразин практически не окисляется, что связано с его способностью к комплексообразованию и более сложному механизму взаимодействия с кислородом, чем по реакции (10.16). При рН = 9–11 достигается максимум скорости реакции (10.16).
, которая отдает четыре электрона молекуле кислорода. Основными факторами, определяющими скорость этой реакции, являются температура, рН среды, избыток гидразина в соответствии с законом действия масс, а также присутствие катализаторов. При комнатной температуре скорость взаимодействия гидразина и кислорода минимальна, но быстро увеличивается с повышением температуры. Так, при t = 105 °С, рН = 9–9,5 и избытке гидразина около 0,02 мг/дм3 время практически полного связывания кислорода составляет 2–3 с. При рН среды менее 7 гидразин практически не окисляется, что связано с его способностью к комплексообразованию и более сложному механизму взаимодействия с кислородом, чем по реакции (10.16). При рН = 9–11 достигается максимум скорости реакции (10.16).
Окисление гидразина кислородом при комнатной температуре может быть интенсифицировано введением органических катализаторов, повышающих скорость взаимодействия в 25–100 раз. В ФРГ активированный гидразин получил товарное наименование левоксина.
Каталитически влияют на скорость реакции также соединения меди и некоторых других металлов.
Гидразин, вводимый в питательную воду или конденсат, взаимодействует с оксидами железа и меди, присутствующими в воде и на поверхности металла, восстанавливая их по следующим суммарным уравнениям:
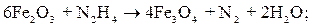
| (10.17) |
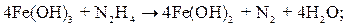
| (10.18) |
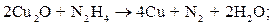
| (10.19) |
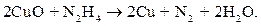
| (10.20) |
В отличие от реакции (10.16) взаимодействие гидразина с оксидами является гетерогенным процессом, на скорость которого кроме температуры и рН оказывают влияние также степень дисперсности твердой фазы (т. е. контакта оксидов с жидкостью) и скорость течения жидкости, которая определяется интенсивностью доставки i гидразина к поверхности частиц. При этом возможно возникновение таких условий, при которых скорость реакций (10.17) – (10.20) превышает скорость реакции (10.16), и реакция гидразина с кислородом будет проходить во вторую очередь, а удаление кислорода из системы станет определяться, например, окислением Fe2+ в Fe3+:
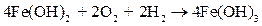 . .
| (10.21) |
Реакция (10.21) происходит с высокой скоростью даже при комнатной температуре и обусловливает связывание кислорода. Гидразин расходуется лишь на восстановление оксидов и гидроксидов, играющих в этом случае роль своеобразных катализаторов.
В котловой воде и в пароперегревателях избыток гидразина разлагается с образованием аммиака:
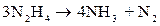 . .
| (10.22) |
Время полураспада гидразина по данным ВТИ
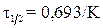 . .
| (10.23) |
где К – константа скорости реакции разложения при соответствующей температуре. При температурах 60 и 300 °С время полураспада гидразина составляет 308 и 1,5 с.
В присутствии оксидов металлов возможно также разложение гидразина с выделением водорода по реакции
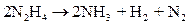 . .
| (10.24) |
Как отмечалось выше, окислительно-восстановительные реакции с участием кислорода можно осуществить при фильтровании воды через нерастворимые в воде высокомолекулярные вещества, имеющие в своем составе группы, способные к обратимому окислению и восстановлению. Примером таких веществ служат электроноионообменники (ЭИ), используемые, в частности, в схемах обескислороживания добавочной воды тепловых сетей, прошедшей предварительную стадию термической деаэрации. Электроноионообменники получают введением в структуры ионита при синтезе материала или в результате сорбции матрицей редокс-групп. На таких смолах возможно одновременное и независимое протекание ионообменных и окислительно-восстановительных процессов. Получение, например, железооксидозакисного ЭИ на основе катионита осуществляется путем его последовательной и многократной обработки растворами FeSO4 и NaOH с промежуточными отмывками. Этот процесс характеризуется следующими реакциями:



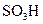
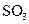



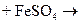
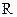
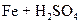 ; (10.25)
; (10.25)
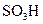
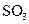




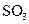
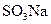


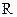
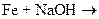
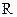
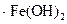 . (10.26)
. (10.26)


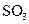
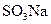
При фильтровании через полученный железооксидозакисный ЭИ кислородсодержащей воды протекает окислительно-восстановительная реакция, снижающая концентрацию растворенного кислорода от 100 до 5 мкг/дм3. ЭИ могут быть получены на основе меди и висмута. В связи с тем, что восстановитель в этом случае должен находиться в нулевой валентности, на заключительной стадии для восстановления гидроксидов этих металлов применяют при обработке ЭИ
5-процентный раствор гидросульфита натрия.
Определяющим при выборе типа ионита для посадки на него восстановительно-окислительных веществ является способность матрицы прочно удерживать нанесенные соединения. Эта способность зависит от знака заряда поверхности ионита. Так, отрицательно заряженная фаза катионита с макропористой структурой (типа КУ-23) прочно связывает положительно заряженные гидроксиды металлов, не допуская смывания их в обрабатываемую воду.
Контрольные вопросы
1. Какими методами удаляются основные растворенные газы (О2 и СО2)?
2. Принцип работы и устройства декарбонизатора.
3. Дайте краткое описание и принцип работы деаэратора.
4. Дайте определение веществам, относящимся к окислителям и восстановителям.
5. Какие восстановители применяют для обработки воды?
Глава одиннадцатая
Дата добавления: 2017-03-12; просмотров: 8443;











